蝉联了五年全球“药王”的修美乐(Humira)在中国大陆获批上市了新的适应症银屑病。
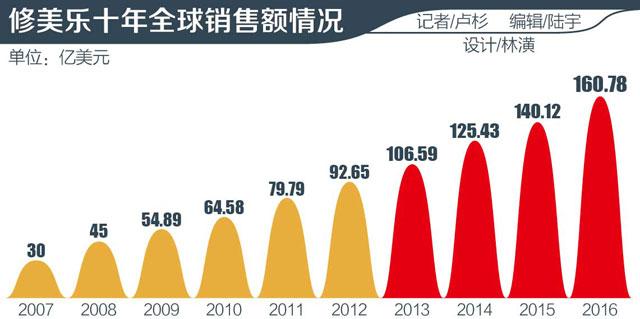
日前,艾伯维中国总经理欧思朗在银屑病上市会上表示,“目前中国市场占艾伯维全球份额还很小,未来潜力很大。”之所以称其为“药王”,因为修美乐是连续五年全球销量第一的生物制剂,2016年销售额达160.78亿美元之高。
修美乐银屑病适应症的上市,成为中国首个用于治疗成年中重度慢性斑块型银屑病的全人源抗肿瘤坏死因子-α(TNF-α)单克隆抗体。同时,由中国初级卫生保健基金会发起、艾伯维中国支持的“手握明天公益捐助项目(银屑病)”也正式启动。
昂贵的牛皮癣新药
修美乐(阿达木单抗注射液)是全球首个获批上市的全人源抗肿瘤坏死因子单克隆抗体,2002年在美国获批上市,作为免疫类药物,目前修美乐在全球获批的适应症多达14个,在超过96个国家或地区销售。
修美乐于2010年在中国上市,加上此次上市的银屑病,目前只有三个适应症在华获批,包括2010年获批类风湿关节炎适应症,2013年获批强直性脊柱炎适应症。艾伯维方面透露,克罗恩病适应症临床研究正在进行,修美乐下一个目标将拓展至消化疾病、虹膜炎眼科以及儿童适应症等领域。相比全球,修美乐在中国还有超过十个适应症排队等待获批。

银屑病是一种慢性、非传染性、炎症性、不可治愈的自体免疫性疾病,俗称“牛皮癣”。全球有大约1.25亿名银屑病患者,中国约有624万。据世界卫生组织2016年发布的《银屑病全球报告》显示,各国公布的银屑病患病率在0.09%-11.43%之间,且患病率持续上升。
银屑病的病因尚不明确,但研究表明,免疫系统和遗传因素在银屑病的发病机制中起了重要作用。银屑病在男性和女性群体中的发病率没有明显差异,且任何年龄都可能得病,最常见于35岁以下的成年人。
“中国银屑病患者分布成陡坡形式,北方病人多,南方病人少,这与气候、人的肤质干燥程度等都有关系。”安徽医科大学第一附属医院皮肤科张学军教授介绍,“三分之一的患者有遗传因素,但发病与否可能跟基因或环境诱发有关。”
银屑病临床以红色丘疹或斑块覆有多层银白色鳞屑的皮损为特征,最常见的发病部位包括头皮、膝盖、肘部及后腰,皮肤损害可泛发全身。4.2%-69%的银屑病患者还伴有指甲病变。此外,银屑病与克罗恩病、抑郁症及葡萄膜炎等合并症密切相关。
银屑病病情因人而异,治疗方案也应根据疾病类型、地点、严重程度、年龄和病史做相应调整。银屑病的治疗目的在于减缓皮肤病变的厚度、红肿、剥落及瘙痒,治疗方案包括局部治疗、光疗及药物治疗(口服或注射)。
与传统治疗方式相比,浙江大学医学院附属第二医院皮肤科郑敏教授表示,“在阿达木单抗中国三期临床研究中,我们看到其展现出三周起效、耐受性良好、持续改善皮损、提升患者生活质量的显著治疗优势。”
修美乐虽在各地上市的价格不一,但单支价格几乎都在7600元以上,以两周一剂的用量来看,患者每年需近20万元费用。目前,修美乐已陆续纳入青岛、甘肃、深圳、克拉玛依、成都大病医保项目。
“患者在自行承担费用接受5支修美乐治疗后,如果医学评估结果显示,该患者需要接受进一步治疗,手握明天项目将为其免费提供5支修美乐药品。”中国初级卫生保健基金会副秘书长胡宁宁表示,“我也呼吁尽快将修美乐纳入国家医保目录,让更多患者受益。”
“目前修美乐还没有接到邀请进行医保谈判。”欧思朗表示,“我们会尽最大努力证明这个产品的价值。”
“药王”之路
自2012年接棒波立维之后,至2016年,修美乐已经连续五年成为全球销量第一的生物制剂,并保持高速增长,2016年全球销售额达160.78亿美元。
根据艾伯维今年1月27日公布的2016年财报,全年净收入256.38亿美元,相比2015年的228.59亿美元增长12.2%,单修美乐就贡献了160.78亿美元,占比62.7%,增长16.1%。
根据行业研究机构EvaluatePharma今年6月最新发布的报告《World Preview 2017, Outlook to 2022》预测,2020年修美乐将以159.01亿美元的销售额稳坐“药王”位子。
2013年1月,艾伯维正式从雅培拆分,获得了包括修美乐在内的多个专利药物研发管线,后独立在纳斯达克挂牌上市。目前专注于免疫学、抗病毒学、肾脏学以及麻醉学四大疾病领域。
2015年,艾伯维斥资210亿美元收购加州生物技术公司Pharmacyclics,后者研发的血液癌药品Imbruvica(依鲁替尼)在2016年为艾伯维贡献了18.32亿美元的销售额。
“修美乐的冠军销售额来源于全球14个适应症中的广泛应用,在美洲、欧洲甚至很多亚洲国家和地区,医保给予了不同程度的支持。”欧思朗表示,“当然产品本身质量和疗效要过硬,得到真实数据的支持和反馈。”
针对中国市场,欧思朗在接受21世纪经济报道记者采访时表示,“我们会配合国家食药监部门做好三期临床;增加在中国的研发人员和质控人员;CFDA加快注册审批改革对我们鼓舞很大,中国病人可以参与全球多中心三期临床,修美乐银屑病适应症也是获得了优先审批,之后会加快将所有研发线的产品带到中国上市。”
专利攻防
修美乐撑起了艾伯维的半边天,艾伯维也想尽办法从药品化合物、制剂、适应症及制备工艺等方面,在全球各个市场上给修美乐设置了重重叠叠的专利组合壁垒。艾伯维方面透露,“全部专利到期要到2030年之后了。”
但由于其核心专利于2016年12月31日已在美国失效,修美乐也频频遭受来自生物类似药公司发起的专利挑战,各方在专利诉讼上打得不可开交。
从2015年末到2016年,安进(Amgen)分别向欧洲药品管理局(EMA)和美国FDA提交了ABP501的上市许可申请,这是针对修美乐的生物类似药物。FDA称其在治疗类风湿关节炎和银屑病方面的疗效与修美乐高度相似。其后,艾伯维对安进提起专利侵权诉讼。
“现在有很多公司在做生物类似药物,同时在美国和欧洲都有诉讼,但修美乐的专利非常全面,我们很有信心。”欧思朗对21世纪经济报道记者表示,“几年内都不太可能会有生物类似物足以挑战这么全面的专利保护。”
一方面,艾伯维以多项专利保护来延缓修美乐生物类似药的推出,另一方面,也加大了对于其他研发项目的投入以对冲风险。
“中国是肝炎大国,在中国市场我们相当看好丙肝药物,临床试验针对基因型1b型的疗效非常显著。”欧思朗表示,“全球来看,针对肿瘤、妇科、免疫等领域的产品也有很多好机会。”



评论