文|氨基观察
11月份刚刚过半,已有两款创新药传来出海的好消息。
先是11月8日,和黄医药的呋喹替尼获得FDA批准;17日,亿一生物宣布,其研发的艾贝格司亭α注射液也获得美国FDA批准。
如果加上上个月底,君实生物特瑞普利单抗的获批,在不到一个月的时间里,已经有三款创新药成功闯关FDA,打入美国市场。
经历过2021年的出海失利之年,2022年的低谷之后,创新药出海的命运齿轮已经开始转动。
草蛇灰线,如今我们迎来出海密集收获的节点,伏笔埋于多年之前。呋喹替尼于2007年合成最初的小分子结构,泽布替尼研发始于2012年,特瑞普利单抗立项于2013年,西达基奥仑赛始于2014年……

时间与技术层面的契合,犹如在合适的季节里选择良田耕种,中国创新药企在出海领域频频突围便也不足为奇。
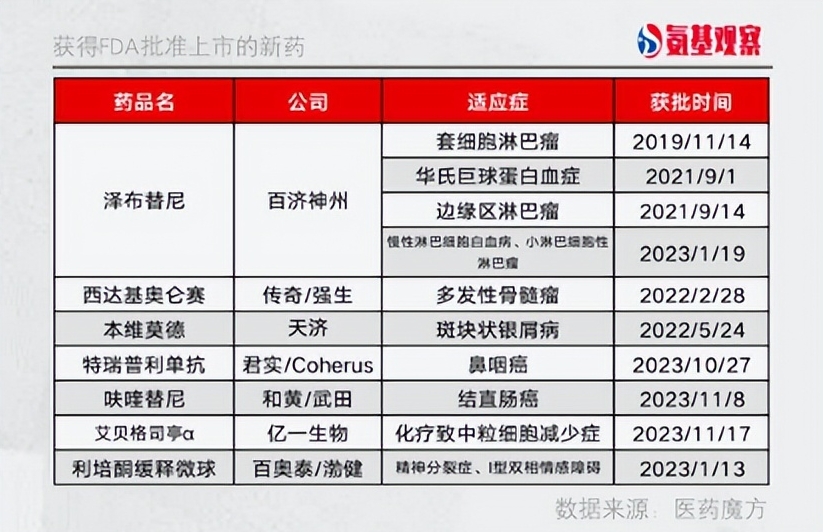
据不完全统计,眼下已有7款国产新药(包括创新药和改良型新药)成功闯关FDA,除此之外,还有替雷利珠单抗、卡瑞利珠单抗等多款产品正在排队等待FDA最后的审批。
风云际会,好药就应该到更广阔的天地去。而上述3款出海药物,走出了3条完全不同的路径:
- 亿帆医药的路径告诉市场,“头对头”如何一步一步慢慢走;
- 君实生物的策略告诉市场,差异化适应症有捷径可走;
- 和黄医药的出海告诉市场,如何借力用力最大程度变现。
这些先行者带来的诸多能够借鉴的宝贵经验,或许值得行业关注。
01 三代长效升白药成功出海
这是11月份第二款成功出海美国的创新药。
今年5月,亿帆医药控股子公司亿一生物的艾贝格司亭α注射液(F-627)获国家药监局批准上市,用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性CIN为表现的感染发生率。
这是亿帆医药首款获批的创新药。6个月后的今天,F-627又获得了美国FDA批准。
大家都知道,由于化疗引起的中性粒细胞减少症,可能导致化疗药物剂量降低、化疗时间延迟,并容易引起发热和感染,影响癌症患者生存质量。
早在1991年,全球首个升白药非格司亭就已经上市,但由于半衰期短,2003年上市的聚乙二醇化修饰技术的长效型升白药培非格司亭问世,整个疗程只需注射一针,很快成为临床中的标准用药。
近年来,长效G-CSF药物日益成为升白药的主流,但其也存在一定局限性,其一是分子量较大,无法透过细胞膜或通过尿液排出;其二是一些患者在长期使用聚乙二醇修饰的药物后,体内可能会产生一种抗体,导致再次用药时可能产生过敏反应。这些都会体现为最终报告的较高的不良反应率。
而F-627是第三代长效升白药物,不需要聚乙二醇化,主要成分是人粒细胞集落刺激因子(G-CSF)双分子和人免疫球蛋白(hIgG2)Fc片段组成的重组融合蛋白,在达到较大分子量、延长疗效的同时也避免了不良反应的发生。
除此之外,不同于国内市场上常见的仿制已有升白药物的思路,F-627是以一类大分子新药进行开发,并且与原研药进行了头对头比较。
全球多中心研究GC-627-05研究,F-627对比培非格司亭,达到非劣效结果。具体来说,第1化疗周期4级中性粒细胞减少症平均持续时间,艾贝格司亭α组不劣于培非格司亭组(0.2天 vs. 0.2天),达到临床终点;安全性方面,SAE和导致停用的AE发生率较低,总体安全性与培非格司亭相当。
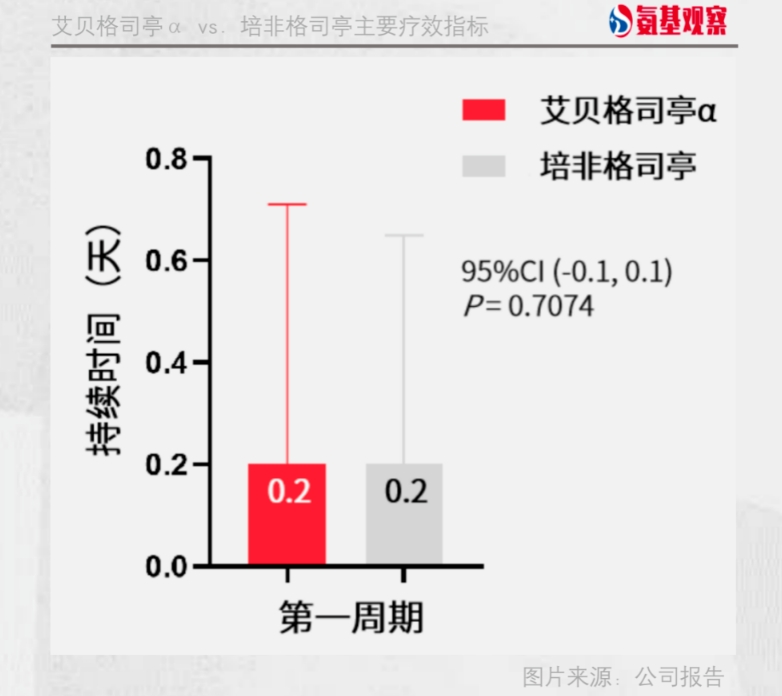
而在中国完成的关键性III期临床试验中,接受F-627治疗的病人在4个化疗周期的中性粒细胞最低值高于原研非格司亭对照组;同时,第3化疗周期4级中性粒细胞减少症的发生率、3级和4级中性粒细胞减少症的发生率低于原研非格司亭对照组。
凭借这样的数据,F-627成功闯关FDA。
02 呋喹替尼不到一年闯关FDA
和黄医药的呋喹替尼是中国药企出海浪潮下又一个成功上岸的创新药。
这是和黄医药研发的一种针对血管内皮生长因子受体(VEGFR)的高度选择性酪氨酸激酶抑制剂,可以限制肿瘤血管的生成,进而阻止肿瘤的生长。
相比起曾经的出海受挫,此次和黄医药的出海颇为顺利。从2022年12月向FDA提交呋喹替尼的新药上市申请,而后获得优先评审,到今年11月8日正式获批上市,用时不到一年。
此次和黄医药出海选择牵手武田制药。1月,双方签订合作,武田制药获得呋喹替尼全球独家许可,开展中国以外的呋喹替尼所有适应症的开发、商业化和生产。
不管采取何种出海方式,回到根本,一款新药能否获批还是取决于其临床数据如何。
呋喹替尼的FRESCO-2全球多中心III期研究结果表明,与安慰剂相比,呋喹替尼组在主要终点总生存期(OS)和关键次要终点无进展生存期 (PFS) 均达到具有统计学意义和临床意义的显著延长。
具体而言,461例接受呋喹替尼治疗的患者中位OS为7.4个月,而230例安慰剂组患者的中位OS为4.8个月;接受呋喹替尼治疗的患者的中位PFS为3.7个月,而安慰剂组患者的则为1.8个月。
除此之外,在注册临床入组患者群体层面,FRESCO-2共纳入了14个国家超过150个研究中心的691名患者,其中日本患者占8%,其余均为欧美患者。这也满足了FDA关于临床试验人群多样性的指导原则。
综合来看,呋喹替尼的成功出海,可谓水到渠成。
03 来自前行者们的出海启示
此前,多个国产新药在FDA的闯关失败,也说明了中国创新药出海之路绝非坦途,需要在研发申报能力、并购整合能力、质量管控能力、临床数据质量管理上与国际标准全面接轨。
回看这些先行者的出海之路,或许能够给予后来者启示。
亿帆医药的路径告诉市场,进入美国市场,头对头临床很重要,但并一定就要“头铁”到底。
亿帆医药目前其取得的还只是非劣性结果,按照亿一生物CEO的说法,艾贝格司亭a的临床计划将分为“两步走”,第一步是先做非劣效性临床研究,证明不逊于当前市场上的药物;第二步再针对其亮点设计相关的临床试验,证明其在特色之处的优效性。
没办法,大部分biotech很难复制百济神州这样高举高打的路线。即使是亿帆医药的出海临床所需的费用也必然不菲,其在全球开展临床研究12项,纳入中、美、欧、澳1265例受试者,中国患者占比不足1/3。从这一点来说,行稳才能致远。
而“头对头”之外,也有捷径可走,特瑞普利单抗则向我们展示了适应症差异化的价值。
其凭借鼻咽癌这一特殊的适应症,用亚洲的临床数据也打动了FDA。在美国,鼻咽癌是一种极为沉重的负担。发病率方面,虽然相对不高,为每10万人0.5例-2例,但问题是患者很容易出现疾病进展,成为R/M鼻咽癌。
R/M鼻咽癌的常规挽救处理包括放疗、化疗和手术,效果均不能让人满意,该类患者的5年生存率中位数只有20%,因此市场亟须一款行之有效的新疗法,这也是FDA愿意给特瑞普利单抗机会的核心原因。
这也告诉市场,出海适应症的差异化选择依然非常重要,这或许能够起到事倍功半的效果。
和黄医药的出海,则告诉市场如何借力用力。在递交上市申请后,和黄医药选择将变现节点前置,其与武田的合作,首付款为4亿美元,监管、开发和商业销售里程碑潜在付款达7.3亿美元,此外还有基于净销售额的特许权使用费。这些回报,对于一家biotech来说,未尝不是一个更有利的选择。
未来,出海这条路依旧难走,但却是创新药企绕不开的路。
不同的资源、能力和使命,决定了药企不一样的路线和节奏。但总归是出海的路径很多,关键是看如何探索。
但不管怎么说,当越来越多药企眼光不再局限于国境线之内,借由出海的东风,向国外药物研发高地发起仰攻,整个行业的发展,也将不可同日而语。




评论