文 | 徐秋雨 何苗 蔡琳敏
编辑 | 陈臣
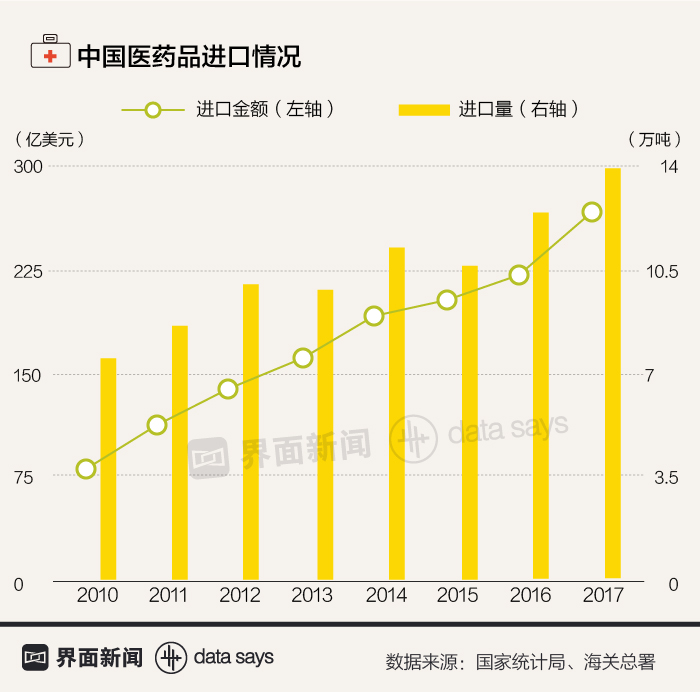
从5月1日起,中国以暂定税率方式对28个税则号的进口药品实施零关税,这将为中国肿瘤患者每年节省约20亿元开销。然而,这项政策的出台也暴露出中国在医药自主研发方面的短板。
比如,中国当前抗肿瘤药市场规模1400亿元左右,其中进口药约占1/3,疗效最好的药物几乎全部依赖进口。
有钱投广告,没钱搞研发
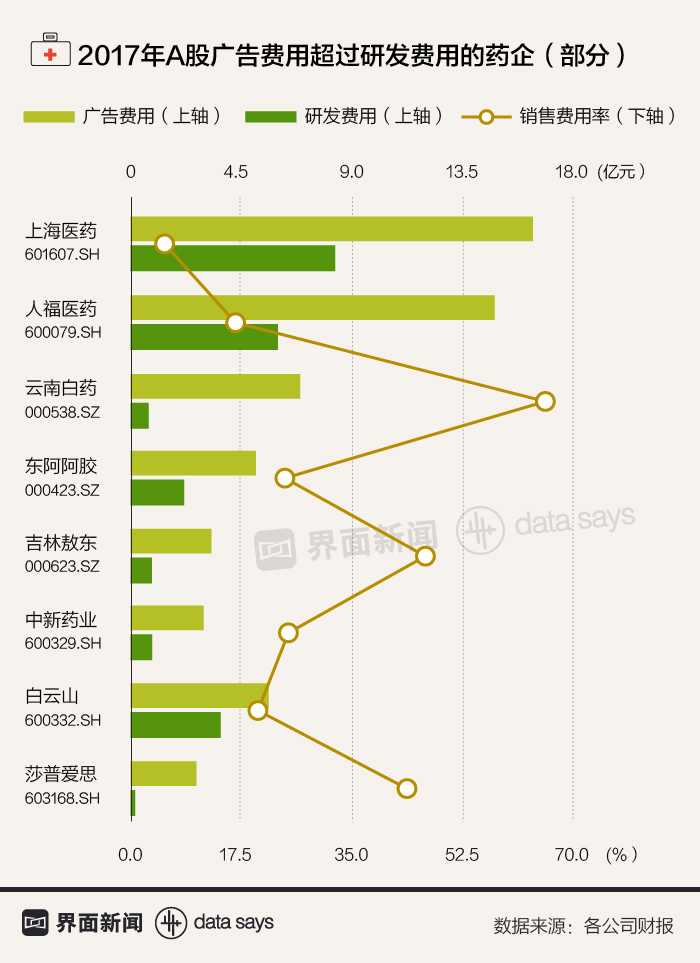
中国医药自主研发能力不足,最直接的原因就是研发投入过低。
界面新闻记者梳理A股药企2017年财报数据发现,云南白药(000538.SZ)、莎普爱思(603168.SH)等知名药企的广告费都数倍于研发费用,销售费用率(销售费用占营业收入比例)最高超过60%。
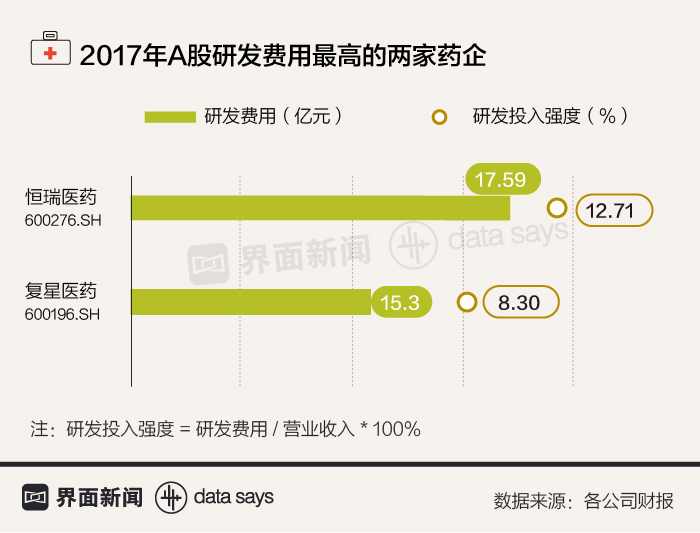
2017年,A股只有恒瑞医药(600276.SH)和复星医药(600196.SH)两家药企的研发费用超过10亿元,研发投入强度仅有约10%。对比阿斯利康、诺华、罗氏等全球知名药企,它们的研发投入都在数十亿美元的量级,研发投入强度在20%左右。
近几年,中国医药的研发投入强度虽然有所上升,但与全球平均水平相比还有相当大的差距。
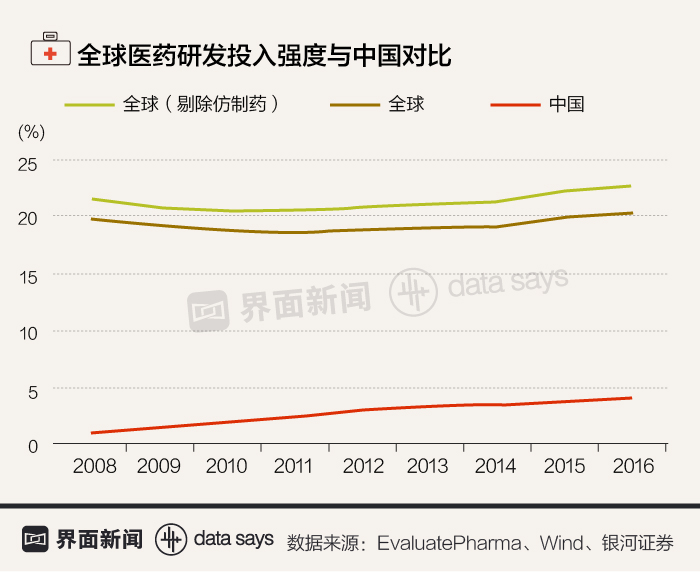
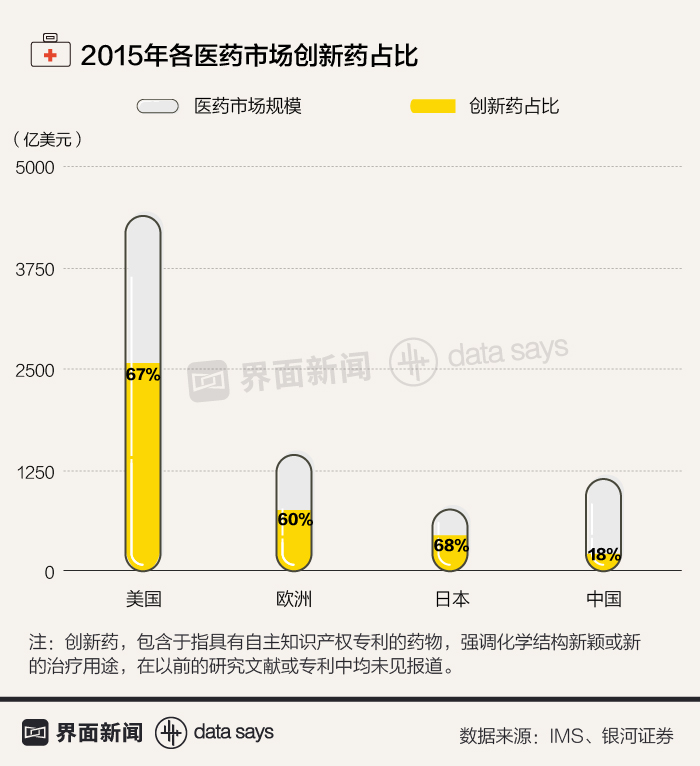
由于研发能力较低,虽然中国已成为全球第三大医药市场,但其拥有自主知识产权的创新药的占比非常低,仅有18%,远低于美、欧、日的水平。
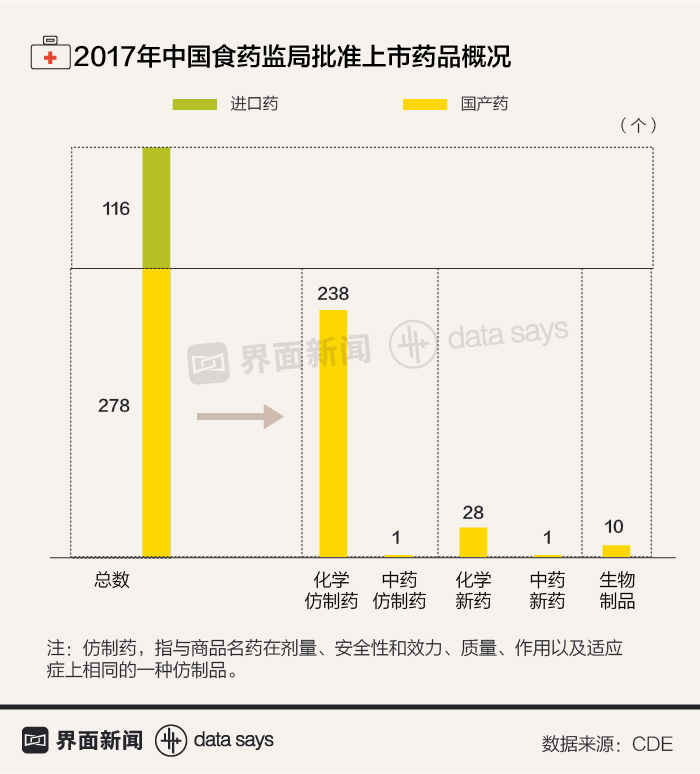
此外,中国还是全球最大的仿制药市场。在国外专利药品保护期到期之后,中国药企就会申请仿制专利药。食药监局药品审评中心(CDE)数据显示,2017年批准上市的278种国产药中,有239种都是仿制药,占比达到86%。
不过,国家卫生健康委员会相关负责人曾表示,由于各种原因,中国仿制药行业大而不强,药品质量差异较大,患者对高质量仿制药的需求与现行药品可及性和可负担性相比,还有一定差距。
另一大弱点:药审速度过慢
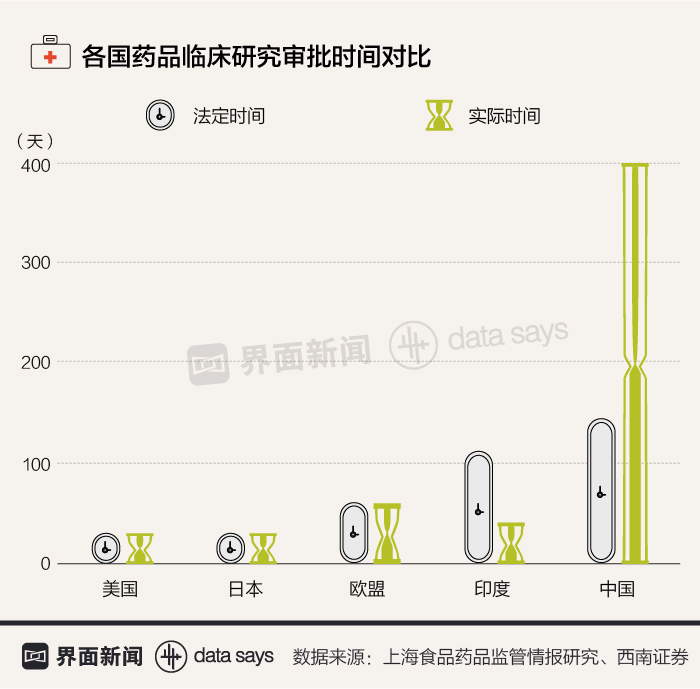
药审速度也是制约中国医药业发展的另一个重要因素。药审的关键环节为临床研究审批和新药上市审批,从目前审批时间的设置来看,中国的临床研究法定审批时间相对美国、欧盟、日本等国家偏慢,且存在严重的审批时滞。
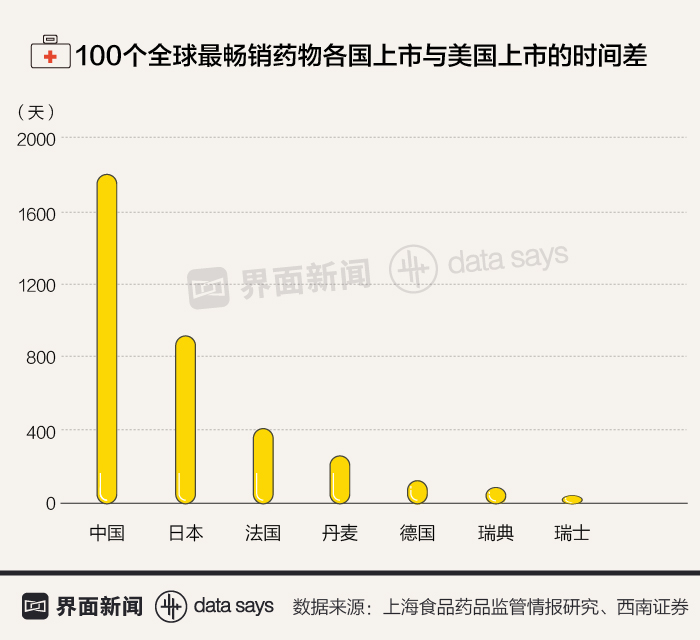
过去几年,中国新药上市时间平均要比欧美晚5-7年。
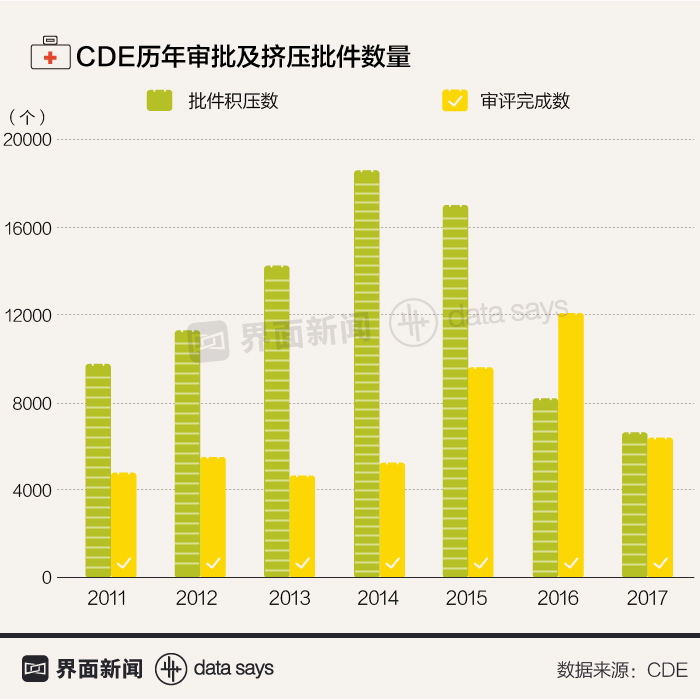
为改善这一局面,国务院办公厅在2017年10月印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,对加快药审提出了若干意见。CDE也在近两年不断扩充药审人员数量、加快药审速度,积压批件数在2016年后已经明显降低。
未来可期
意识到中国在医药研发和创新方面的不足,近期国家推出多项利好政策,支持创新药的研发。最近的一项政策是在4月份,国家食药监局组织起草了《药品试验数据保护实施办法(暂行)(征求意见稿)》,提出“对在中国境内获批上市的创新药给予6年数据保护期,创新治疗用生物制品给予12年数据保护期”,进一步拓宽了保护对象,延长了保护时间。
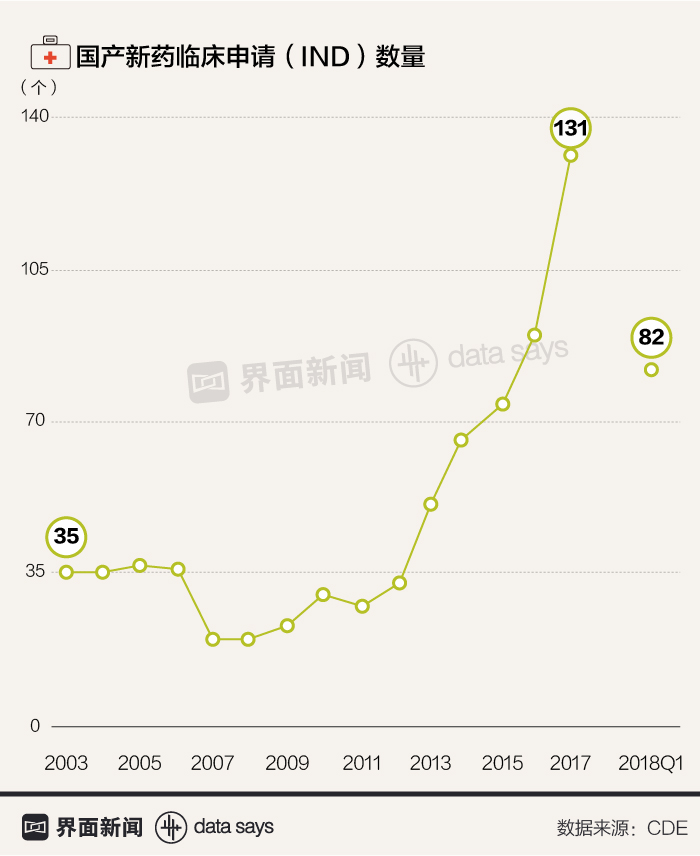
受政策鼓舞,国产新药临床申请数量在近年快速增长,未来几年中国或将迎来创新药高潮。
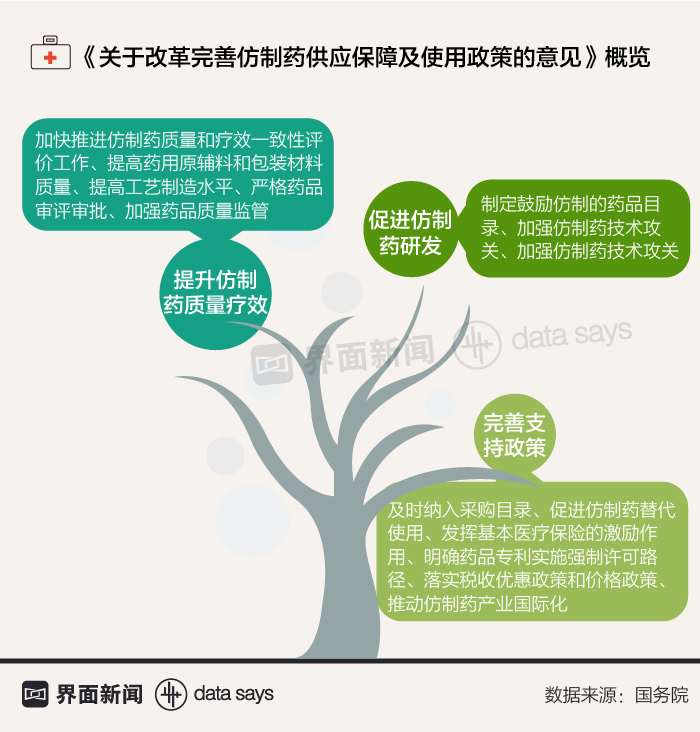
同时,中国也在提升仿制药质量和疗效方面下了功夫。今年4月,国务院办公厅印发了《关于改革完善仿制药供应保障及使用政策的意见》,提出要促进仿制药研发、提升防止了质量疗效、加快一致性评价工作等。



评论