记者 | 刘素楠
编辑 | 徐菲
“药品上市许可持有人制度将给整个制药产业带来很大改变,它鼓励创新,只要你有足够的资金和能力把药品研发出来,就能享受到产品带来的利润。”3月13日,和记黄埔医药(上海)有限公司资深副总裁吴振平接受媒体采访时说,“新药开发的门槛降低了,甚至可以说,只要有一支笔、一个想法、一笔资金,就能成立医药公司。”
药品上市许可持有人制度(以下称MAH制度)是欧洲、美国、日本等制药发达国家和地区在药品监管领域的通行做法,该制度采用药品上市许可与生产许可分离的管理模式,允许药品上市许可持有人自行生产药品,或者委托其他生产企业生产药品。其与此前管理制度最主要的区别在于,允许研发机构及科研人员持有药品批准文号,成为药品上市许可持有人,并对该药品的安全性、有效性和质量可控性负全面责任。
上海2016年获批试点MAH制度。2018年2月27日,上海远心医疗科技有效公司的单道心电记录仪成为试点医疗器械注册人制度后获批上市的首个产品,上市时间比法定时间缩短了82%。2018年9月5日,和记黄埔医药研发的呋喹替尼正式获批上市,这是上海通过MAH试点上市的第一个一类创新药,也是中国首款自主研发的抗结直肠癌新药。
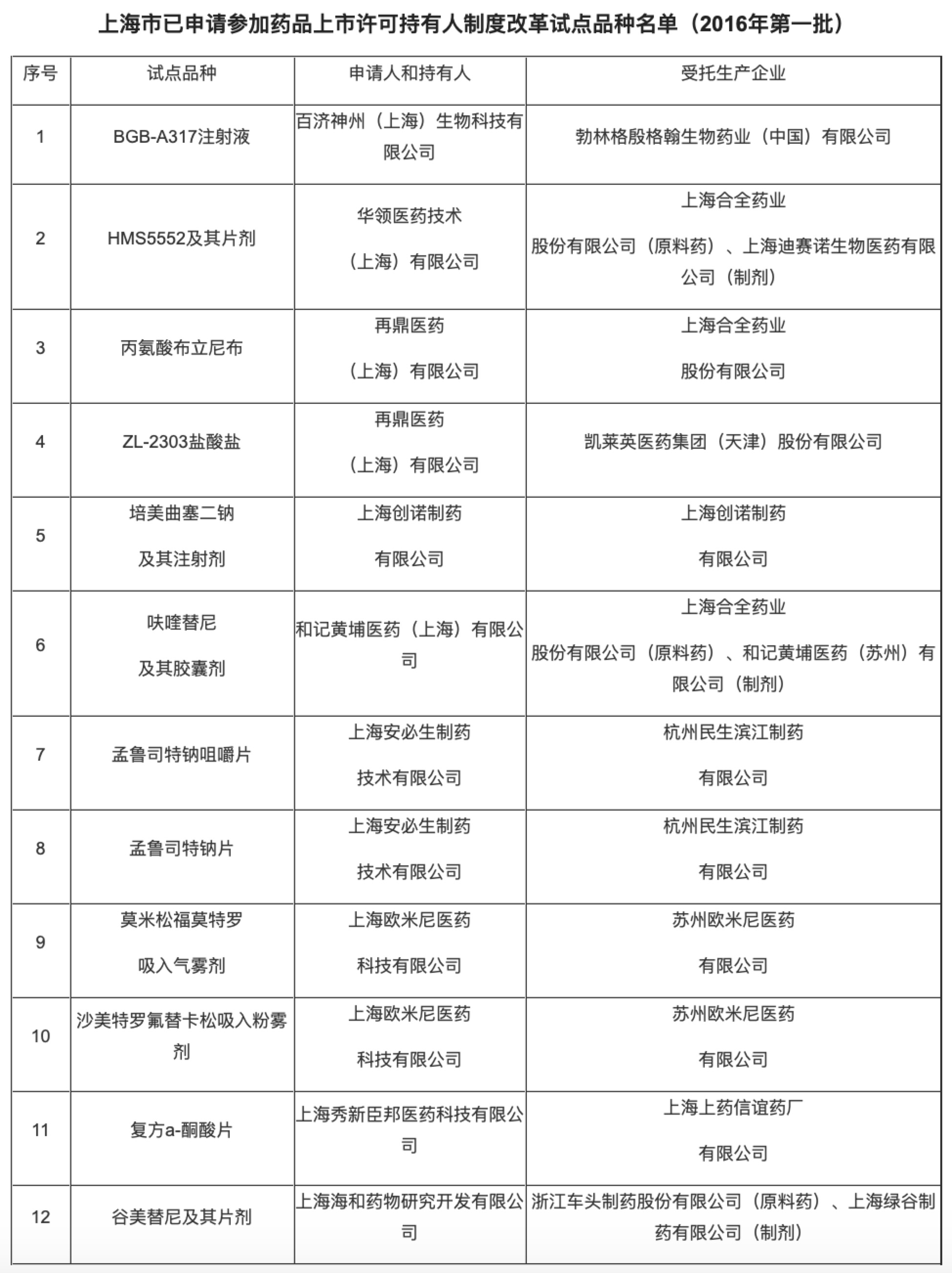
截至2018年11月13日,上海市共受理43家申请人申报的114件MAH试点,申请共计68个品种,包括30个一类创新药。其中,浦东新区35家企业申报了54个品种,此中有31家企业46个品种落在张江。
上海张江素有“药谷”之称,也是MAH制度的策源地。

一直以来,中国生物创新药品种的研发者苦于没有高水准生产企业可委托代工,同时日益稀缺的土地资源也成为制约产业发展的主要瓶颈。早在十多年前,张江高科技园区走访制药企业时就发现,生物制药合同生产的创新模式可以成为加快生物制药技术研发和转化的“关键撬动点”,因而开始寻找合适的生物制药合同生产服务企业落户张江,并最终引入了全球知名生物制药合同生产商勃林格殷格翰公司。
2008年起,张江生物医药基地与勃林格殷格翰公司共同探索推进MAH相关工作,双方携手打造跨国药企在中国的第一个且目前唯一一个具有国际标准的生物制药基地。2013年6月,双方启动了国内首个基于哺乳动物细胞培养技术生产的生物制药基地的建设。
而作为上海市MAH制度创新试点工作的牵头部门,上海市食品药品监督管理局会同上海市科委、浦东新区市场监管局等部门,围绕MAH试点需求和方案深入调研,在张江相继开展上市许可人制度研究、CMO(合同代加工)试点研究、CMO风险控制与保障研究等系统性调研,为上海市加快完善上报国家的试点工作方案做出了充分的研究和论证。
自2008年探索呼吁了7年之后,政策利好相继传来。
2015年11月,第十二届全国人大常委会第十七次会议通过《全国人民代表大会常务委员会关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》。2016年5月,国务院办公厅印发《药品上市许可持有人制度试点方案》,在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川等10个省(市)开展药品上市许可持有人制度试点。
这意味着,我国开始建立药品上市许可持有人制度。
2016年7月,上海市食品药品监督管理局开始全力推进MAH制度改革试点落地,制订《上海市开展药品上市许可持有人制度试点工作实施方案》,并发布了《药品上市许可持有人申请办事指南》。
同年10月,上海公布首批试点品种名单。9家药物研发机构、11家药品生产企业递交了12个品种参加药品上市许可持有人制度改革试点的申请资料。其中,和记黄埔医药研发的呋喹替尼胶囊进入上海市食药监局MAH制度首批试点品种名单。
和记黄埔医药位于上海浦东张江高科技园区,是一家创新药物研发的生物医药公司,主要研发抗肿瘤及免疫类疾病的创新药。2007年8月,该公司“明星药”呋喹替尼首次完成设计与合成,2014年正式启动呋喹替尼三线治疗晚期结直肠癌的III期临床研究(简称FRESCO研究)。
2017年5月,和记黄埔医药以MAH申请人身份向国家药品监督管理局递交了呋喹替尼胶囊的新药上市申请。当年9月,国家药监局授予呋喹替尼“优先审评”资格。2018年9月4日,呋喹替尼的上市申请获批,上海合全药业股份有限公司、和记黄埔医药(苏州)有限公司分别是原料药和制剂的受托生产企业——这也是上海第一个在MAH制度下获批的创新药。
“获批后公司上下很激动,这对我们研发新药是莫大的支持,对国内患者来说是一个福音,这也是在政策利好的情况下,多方共同努力的结果。”和记黄埔医药资深副总裁王清梅说道。
从获批到上市,和记黄埔医药发现呋喹替尼受到了企业经营范围的限制。“合全药业和和记黄埔医药苏州公司不是这个药物的拥有者,和记黄埔医药是呋喹替尼的持有人,但营业范围却不包括销售。”和记黄埔医药首席营销官陈洪回忆。
和记黄埔医药就此和自贸区、浦东新区市场监管部门沟通,市区两级市场监管部门和上海市食药监局共同讨论,在多方协调和支持下,最终上海自贸区市场监管局为和记黄埔医药办理了变更登记,发出全国首张增加“药品委托生产(详见药品上市许可持有人药品注册批件)”经营范围的营业执照。
2018年11月25日,呋喹替尼正式上市。
“MAH制度试点以前,只有生产企业可以销售药品,显然我们公司不具备这个条件。”和记黄埔资深副总裁吴振平说,有了MAH制度,专注药品研发的企业不需要再建一个生产工厂就可以销售药品,也就能将更多资金用于研发,集中精力去做擅长的事情。
“药品上市许可持有人制度将给整个制药产业带来很大改变,它鼓励创新,只要你有足够的资金和能力把药品研发出来,就能享受到产品带来的利润。”他进一步指出,“新药开发的门槛降低了,甚至可以说,只要有一支笔、一个想法、一笔资金,就能成立医药公司。”

MAH制度试点对于上海“药谷”而言,意义非同寻常。
2017年5月16日,张江生物医药基地与勃林格殷格翰公司共同打造的生物制药基地正式建成启用。此举进一步完善了张江园区生物医药产业链的服务能级,标志着张江园区可为中国与全球客户提供符合世界一流标准的生物制药产品。
目前,该基地一期已建成一条(2000升)生产线,设计年产能60-80公斤单克隆抗体蛋白质。如今,基地已签约服务于10余个项目,并与百济神州、再鼎医药、北海康成三家张江园区的创新企业签订代工合同,所委托生产的三个药物均为价值25亿人民币年销售额的创新药物。
MAH试点涉及的风险管控是一项重点工作。张江高科技园区推出了与试点工作相配套的“社会商业保险+政府保障资金”的风险保障体系建设工作。张江高科技园区管委会设立了《张江高新区核心园药品上市许可持有人制度合同生产试点风险保障资金》,制定出台了风险保障资金的《实施意见》、《实施细则》和相关办事指南,为试点的实施推进奠定良好基础。
与此同时,张江借助多年合作研究的丰厚积累,联合上海市浦东新区生物产业行业协会、上海市质量协会,共同推进《药品上市许可持有人与受托药品生产企业质量协议撰写指南》的起草制订发布工作,希望借助MAH试点制度在上海的成功开展,可以将医疗器械行业也纳入MAH试点的范畴。
经过与上海市食药监局、浦东新区市场监管局以及行业内领军企业的共同研究和推进,张江高科技园区于2017年底成功将MAH制度在上海市范围扩展至医疗器械注册人制度试点。
目前,张江生物医药产业形成了生物技术和医药产业创新集群,成为研发资源集聚、新技术新模式率先突破的标志性科技园区。2017年,张江园区生物医药产业发展总体表现出稳步增长的态势,营业总收入593亿元,同比增长7.9%,实现工业总产值290.24亿元,增长10.0%,占上海全市指标的近三分之一。
在生物医药研发领域,张江集聚了跨国公司研发中心及总部16家、国内大型药企10家、中小型创新企业300余家、精准医疗领域企业24家;在高端医疗器械领域,张江园区内已集聚医疗器械类企业200多家。
国家食药监总局每批准3个一类新药,就有一个来自张江;张江企业申报新药临床获批率是全国平均水平的3倍以上。目前,张江在研药品134项、在研医疗器械18项,预计将在未来五年内迎来研发成果爆发期。




评论