文|果壳 喵奴·Catherine
编辑|代天医
自新冠肺炎爆发到现在,差不多半年了。全球感染和死亡人数每天飙升,但对于这个病毒的特点、详细致病机制,以及给患者带来的损伤,我们仍然没有彻底弄清楚。
今年2月起,国内专家提出对新冠肺炎逝世患者进行系统解剖,以进一步了解病毒对患者造成的损伤。但是,对于高传染性疾病死者的解剖,并不是撸起袖子、拿起刀子就能开始进行的。
图丨pxhere
不清楚病毒是死是活,按活的防护
关于新冠病毒在尸体内的存活时间,现在仍没有相关的研究和报道。但与新冠病毒相近的严重急性呼吸综合征(SARS)病毒,感染活性最长可以在肺内保持至死后175小时,在小肠内也长达160小时[1]。

近期有研究人员回顾历史文献并提出,对于解剖新冠病毒感染尸体的工作人员,接触尸体表面、飞溅形成的气溶胶、器官以及体液等,都有可能造成感染[2]。所以,无论是解剖前环境、工作人员的防护、解剖过程中获得的样本,还是解剖后的清洁和尸体处理,都需要做好万全的准备。
今年3月,美国俄克拉荷马州两例新冠肺炎死者解剖是这样进行的:在一个配备有逆流空气处理系统的独立负压隔离室内,工作人员穿戴从头到脚、内外共两层的个人防护装备,包括N95口罩等。离开实验室前,先脱下外面一层防护装备,在室内进行消毒处理,然后在淋浴室进行一次彻底的清洗。
进行开颅等可能产生粉尘的操作时,开启抽吸装置吸取粉尘,减少可能的污染。取得的新鲜样品放置在专门的容器内,防止转移过程的污染。病理样本则直接用福尔马林固定[3]。
所有的这些,都是为了尽最大可能减少解剖过程中可能产生的污染。

美国俄克拉荷马州首席验尸官办公室独立负压隔离室内,穿着全套解剖装备的病理技师站在配有逆流空气处理系统的解剖台前 | 参考文献[3]
准备好各种装备和善后工作,关于新冠肺炎的解剖终于可以开始了。实际上,疫情爆发以来,国内外已经进行了不少关于新冠肺炎的系统解剖,相关报告也已经公布。结果正如新冠肺炎的名称,肺是新冠病毒的主要攻击目标。
肺,是第一“战场”
弥漫性肺泡损伤是SARS、中东呼吸综合征及新冠肺炎共有的典型肺部病变[4, 5],也是新冠肺炎患者呼吸困难的直接原因之一。
健康人的肺泡是由单层肺泡上皮组成的囊泡,腔内有一薄层液体,肺泡与肺泡之间有肺泡隔,这层隔包含毛细血管网等。上述这些结构将肺泡内的空气与血管内的血液隔开,构成“气-血屏障”,也称为“呼吸膜”。
随着吸气和呼气,肺泡像气球一样胀大和缩小,吸入的氧气通过这层屏障进入血液流向全身,毛细血管内的二氧化碳则被我们呼出。
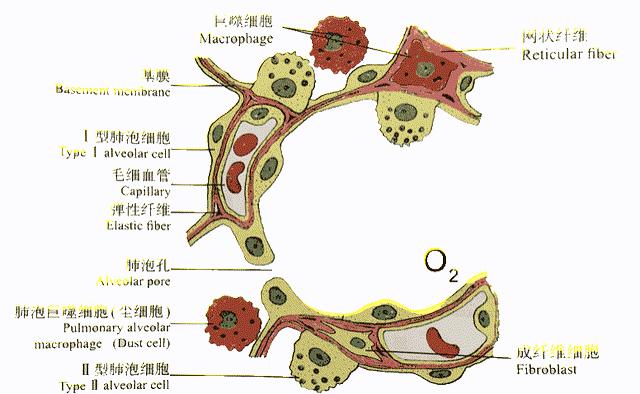
肺泡与肺泡隔 |《组织学与胚胎学》[6]
而弥漫性肺泡损伤是指病毒侵犯肺组织,造成肺泡上皮细胞损伤脱落,肺泡隔的毛细血管充血,血管内液体渗出并在肺泡积聚。这种改变从肺局部扩散到几乎整个肺组织,造成肺水肿。此时的肺泡,就像一个渐渐充满水的气球,无论是打气还是放气都渐渐变得困难,造成患者呼吸困难、胸闷气短的症状。
病情进一步发展,渗出物在肺泡腔表面形成一层膜状结构(透明膜),导致气-血屏障增厚,氧气和二氧化碳的交换进一步受阻,呼吸困难症状加重,严重者甚至会出现呼吸衰竭。
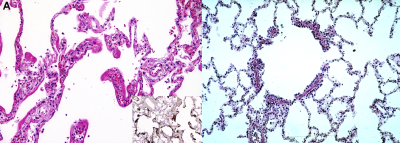
左图可见显微镜下肺泡膜增厚,右下角小图是特殊染色下的“透明膜”(深褐色部分)[5];正常的肺泡膜应像右图一样 | Color Images of Histological Sections
同时,以巨噬细胞为主的免疫细胞在肺泡聚集。肺变成了免疫细胞对抗病毒的“战场”,病毒增殖并破坏肺组织,免疫细胞攻打病毒的时候,也避免不了把战场打得坑坑洼洼,这边缺、那边漏的。肺的自我修复能力,跟不上病毒和免疫细胞的破坏,气体进出肺泡和交换过程受阻,加剧呼吸困难等症状。
重症,可能与气-血屏障破坏有关
中日友好医院呼吸与危重症医学科的曹彬教授认为,新冠病毒除了肺泡上皮细胞,还会侵袭血管内皮细胞。病毒通过结合血管紧张素转换酶II(ACE 2)进入人体细胞肆虐。这个ACE 2,不仅大量存在于肺泡上皮细胞,血管内皮细胞上也很多[7]。
曹彬教授还认为,在病毒侵犯肺组织的初期,轻症或无症状患者肺泡内的巨噬细胞启动了肺部的免疫反应,很好地控制住病毒,没有引起进一步的损伤和免疫反应。
但重症患者肺部的巨噬细胞未能将病毒控制住,病毒进一步侵犯毛细血管内皮细胞,破坏上面提到的“气-血屏障”。肺泡与血管之间的阻隔出现缺损,一方面毛细血管内的血浆更多地渗出到肺泡腔,把肺变成更加混乱的“战场”。另一方面,病毒不断增殖并破坏肺泡,钻进毛细血管内,随着血液到达各个器官,使“战场”进一步扩大,患者的症状更加严重[8]。
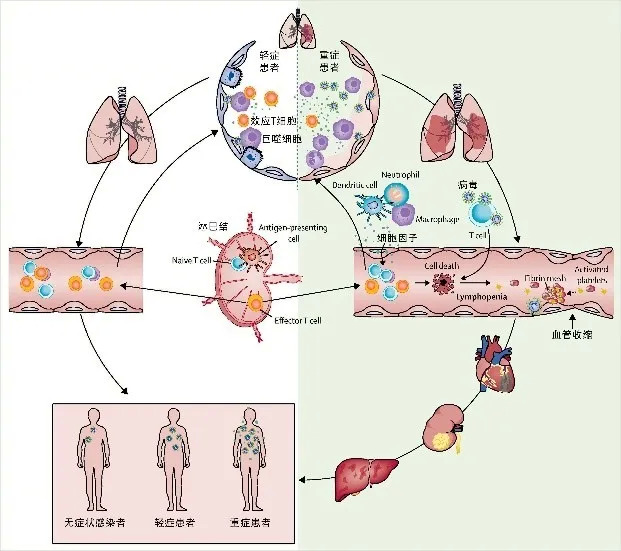
曹彬教授提出的轻重症差异机制,别的不说,单看右边免疫细胞种类就知道重症患者体内“战况”多“激烈” | 参考文献[8]
肾,也许是另一重要“战场”
“气-血屏障”涉及的主要细胞是肺泡上皮细胞以及毛细血管内皮细胞。除了肺,人体内还有一个毛细血管十分密集的器官——肾,它也被怀疑是新冠病毒的重要攻击器官。[5]
肾通过筛子一样的滤过膜对血液里的物质进行过滤,然后进一步处理形成尿,毛细血管内皮细胞是滤过膜的重要组成部分。美国一项新冠肺炎研究发现,15例接受肾检查的死者中,14例有急性肾损伤,肾组织内有高浓度的病毒RNA[5]。这项研究和瑞士另一项研究在肾内的血管内皮细胞中,直接观察到了病毒颗粒[9]。
因此,肾有可能是新冠病毒攻击人体的另一个重要“战场”。
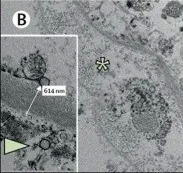
图中箭头指示了肾小球基底膜旁的毛细血管内皮细胞内的病毒颗粒 | 参考文献[9]
体内其他可能的“战场”
近期有研究在新冠肺炎患者精液内检出病毒。很多人在害怕“啪啪啪”可能传染新冠肺炎的同时,也在担心新冠肺炎会不会影响“啪啪啪”的能力。
研究人员的确在17例新冠肺炎死者的睾丸组织内检出了病毒RNA,但并未提及睾丸的病理变化,也未见其他新冠肺炎患者睾丸的病理检测研究结果[5]。大家暂时不用过分担心,检出病毒并不一定意味着器官被攻击,看看大脑就知道了。
在4例新冠肺炎死者的检查中,尽管在大脑内检出了病毒RNA,但未见大脑有明显的炎症细胞聚集或神经元坏死,其中3例大脑有轻微的缺氧损伤[5]。就是说,这几名患者的大脑没有成为人体抗击病毒的“主战场”,仅仅是“粮草”(氧气)供应有点缺乏,受到了一点牵连。
不过,目前新冠肺炎死者解剖研究有限,还需要进一步研究证实各个器官的受损情况。
随着研究逐渐揭示新冠肺炎的病理生理机制,新冠病毒貌似一个在人体内到处作恶的“混混”,让我们闻之而色变。实际上,目前很多问题还没有十分确切的定论,我们现在只需要戴口罩、勤洗手、少聚集,少一点脑补或惊恐,其他的交给科学家就好。
参考文献
[1] J W Tang, K F To, A W Lo, et al., Quantitative temporal-spatial distribution of severe acute respiratory syndrome-associated coronavirus (SARS-CoV) in post-mortem tissues. J Med Virol, 2007. 79(9): p. 1245-53.
[2] I Aquila, M A Sacco, L Abenavoli, et al., SARS-CoV-2 Pandemic: Review of the Literature and Proposal for Safe Autopsy Practice. Arch Pathol Lab Med, 2020.
[3] L M Barton, E J Duval, E Stroberg, et al., COVID-19 Autopsies, Oklahoma, USA. Am J Clin Pathol, 2020. 153(6): p. 725-733.
[4] 王慧君, 杜思昊, 岳霞, et al., 冠状病毒肺炎的病理学特征回顾与展望. 法医学杂志, 2020. 36(01): p. E028-E028.
[5] T Menter, J D Haslbauer, R Nienhold, et al., Post-mortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings of lungs and other organs suggesting vascular dysfunction. Histopathology, 2020.
[6] 组织学与胚胎学. 第2版 ed. 2013: 人民卫生出版社.
[7] C M Ferrario, J Jessup, M C Chappell, et al., Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation, 2005. 111(20): p. 2605-10.
[8] H Li, L Liu, D Zhang, et al., SARS-CoV-2 and viral sepsis: observations and hypotheses. The Lancet, 2020. 395(10235): p. 1517-1520.
[9] Z Varga, A J Flammer, P Steiger, et al., Endothelial cell infection and endotheliitis in COVID-19. The Lancet, 2020. 395(10234): p. 1417-1418.





评论