文|财健道 陈鑫
制图 | 李泽坤、敖雨璐
不久前,湖南怀化人武仕平刚满1岁的儿子确诊为脊髓性肌萎缩症(SMA),眼见小生命肌肉慢慢萎缩,无奈有药却买不起,只能勉强用呼吸机维持生命,他决定在网上发帖“求药”——70万元一针的诺西那生钠注射液(Spinraza),每一滴价值人民币7000元。
9000公里外的南半球,同一种药的政府采购价为11万澳元/支,澳洲患者只需自付41澳元(约人民币206元)。巨大的价格差掀起网络舆论热潮,让罕见病SMA获得前所未有的关注。
同药不同价,罕见病药物到底该定多少钱?
01、新药研发:0.1%的成功和99.9%的失败
一年前,跨国药企诺华研发的一次性治愈SMA的基因治疗药物Zolgensma获美国FDA批准上市,210万美元(约1448万元人民币)一支的天价赋予其“史上最贵药物”之名。
相比之下,渤健公司的诺西那生钠的单价仅为Zolgensma价格的1/20,但患者需每年至少注射3剂,甚至可能终生注射。如果患者3岁确诊,寿命达到50岁,按照上述注射频率和价格,全部自费需耗人民币1.029亿元。
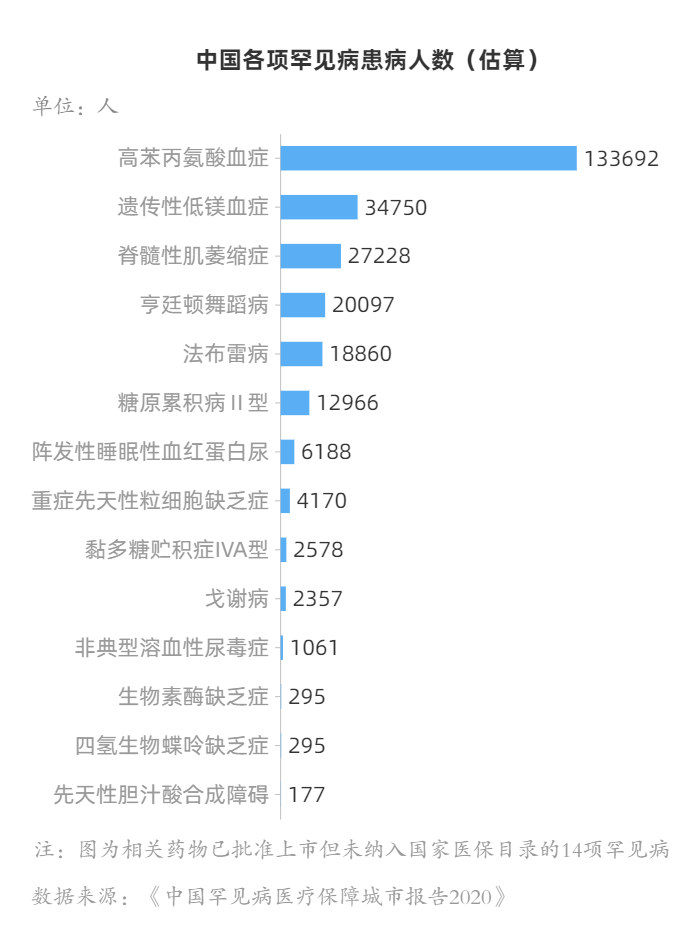
关于我国究竟有多少罕见病患者,目前并未有权威的统计数据。中国罕见病联盟秘书长、北京协和医院党委书记张抒扬曾指出,中国约2000万的罕见病患者,且每年新增患者超过20万。由于罕见病往往确诊难、药价高、进不了医保,这些“折翼天使”过早离开人世,而“噩梦”仍潜藏在基因中遗传给下一代。
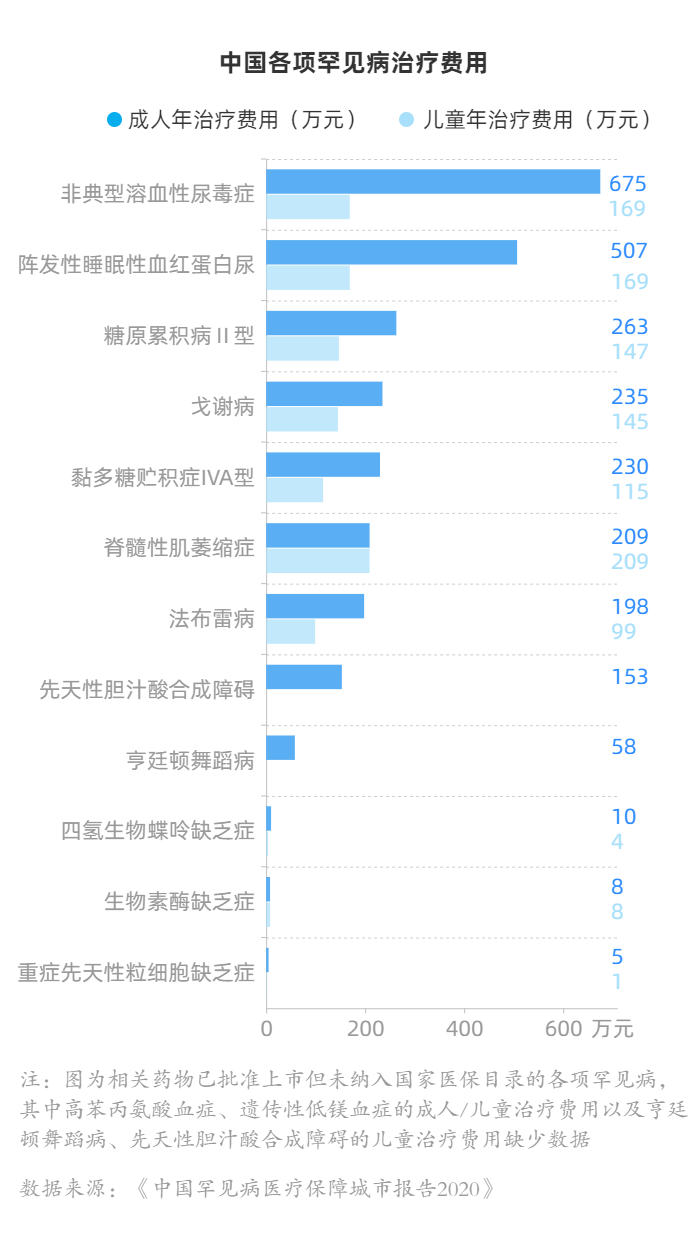
治疗非典型溶血性尿毒症、阵发性睡眠性血红蛋白尿的依库珠单抗,成人年治疗费用分别高达675万元和507万元;庞贝病,263万元;戈谢病,235万元……
根据IQVIA艾昆纬中国发布的《中国罕见病医疗保障城市报告2020》,仅成人年治疗费用在200万以上的药物,就有5种;在儿童用药方面,诺西那生钠以年209万元位列榜首。
在制药行业工作过40多年的唐纳德·基尔希曾在《猎药师》一书中揭示了基因药物的高价之谜:“在药物研发领域,最艰难、最重要的抉择就是——全力以赴还是索性放弃,孤注一掷还是及时止损。做抉择时科学家往往无法获得足够的信息,因此该放弃而没放弃的情况很常见,这也解释了为什么50%~75%的临床试验都以失败而告终。”
药企研发人员上报的研发项目中,往往只有5%能得到管理层的批准,其中约2%能研发出获得美国FDA认可的药物——也就是说,药物研发成功的概率只有0.1%。失败的那“99.9%”的研发成本,都将由这“0.1%”背负。
当科学家费尽心思研发出来的成果投入市场,药企该如何触及患者少、规模小的罕见病市场,才能赚回研发成本,还要小心不背上“黑心”产商的骂名。更何况,在患者把药吃进去之前,你永远都没法知道药的功效。
在美国,诺西那生钠的定价为首年75万美元,之后每年37.5万美元,与之对应,该药2017年、2018年为渤健公司创造了8.84亿美元和17.24亿美元的销售额。诺西那生钠公布定价之初,美国华盛顿州医疗管理局的一位官员曾对渤健公司直言:“这个价格是不道德的。”随后在欧洲和加拿大,该药物也遭到了类似的批评和抵制。
2019年4月3日,美国临床与经济评论研究所(ICER)公布了对诺西那生钠和Zolgensma的临床疗效及价值进行评估的最终报告,极度认可了两种药物的临床疗效,以及对SMA患者及其家人生活品质的巨大改善。ICER的测算标准,即“每多获得一个生命年,美国社会愿意支付10万~15万美元”,而报告也是用以支持或者反对药品的最初上市价格的有力武器。
当然,评估报告也毫不留情地指出,诺西那生钠目前定价太高,远远超过了成本效益阈值,应该降价83%~90%;Zolgensma彼时还未获批上市,建议上市后将价格定在31万~89.9万美元之间,尽管企业上市最终采用先前估测价格210万美元。
即使前述“0.1%”背负了“99.9%”的成本,价格的形成也远非“只看成本”这么简单,疗效、刚需、专利垄断都会推高救命药的价格,原研药企对专利药的定价,就像保险行业的精算师一样,需要细腻的算法,高了低了都不行。归根结底,价格的形成取决于供需双方的博弈。
2017年,两种药物还未上市,北京市美儿SMA关爱中心曾统计过中国SMA家长的价格预期及支付能力,结果显示,如果是长期用药,绝大多数家庭能承受的价格是每年10万人民币以内;如果是一次性治愈,有家长最多愿意支付150万人民币。
诺西那生钠只能算暂时拥有优势。如果打着“一次性治愈”王牌的Zolgensma进入中国,正在开展III期临床的罗氏口服药物Risdiplam、以及安斯泰来、Cytokinetics合作开发的Reldesemtiv进展顺利,药企是否还会坚持原来的定价?
种种因素是否最终影响中国医保目录内药品谈判,尚不知晓。对于支付方而言,罕见病药物证据的短缺将为支付决策带来很大的不确定性——如何避免为没有效果的药物付费?如何通过设置支付限制,避免不可预期的支出?能不能在确定人群中观察到预期收益?
只有随着药品上市时间的延长,这些不确定性才会在时间的迷雾中逐渐明晰。
02、10年之变:从“无药可用”到“谁来支付”
一周过去,“一针70万”的话题热度不减,媒体也相继刊出不同角度的报道聚焦罕见病。
读完《人物》杂志讲述诺西那生钠诞生与SMA中国家庭困境的旧文后,长期关注罕见病的北大遗传学系副主任黄昱发了一条朋友圈感慨:“十年前我们在讨论怎么研发?哪里有药?怎么引进?十年后的今天,我们开始讨论如何买得起?如何推进医保支付?如何融资研发?——这就是进步。”
尽管全球各地医疗保障程度不一,但一个既定不变的事实是,有药可用是天文数字前的“1”,审评审批和医疗保障不过是后面的“0”,总会有的。如何注重罕见病的特殊价值,让成本昂贵的罕见病药物进入医保?
在大部分罕见病药物保障较为成熟的市场,罕见病药品支出占整体药品支出的比例大多稳定于2%~5%。在欧洲,罕见病药物占比的历史峰值仅在 3%~6.6%;在澳大利亚,救命药项目的支出占比仅为1.18%;在我国台湾地区,罕见病及血友病药费占全民健保的比例也常年维持在2%之间。
与欧美地区相比,中国罕见病支出占总体医保费用的比例较低。从首都北京的情况来看,2017年北京市7种罕见病医保患者共2124人,发生总费用3923万元,占全市医保费用的0.04%。
“0.04%”和“2%”之间,存在着一条鸿沟。如果这条鸿沟没有填平,罕见病悲情就会不断上演,触动社会敏感的神经。

英国国家卫生与临床优化研究院(NICE)推荐一种药物进入英国国家医疗服务体系(NHS)时,要求普通药物的增量成本效益比须低于每个质量调整生命年花费3万英镑的阈值,而对于罕见病药物采用特定评估模式,NICE将评估标准的阈值调整为每个生命年花费10万英镑(针对有显著疗效的评估标准的阈值可以升至30万英镑),并将疾病严重性、药物创新程度、社会影响等其他价值因素纳入考量范围。
尽管不同于英国为罕见病药物建立单独评估制度,欧洲其他国家也对罕见病药物的评估标准进行了调整。比如在德国,普通药物的总体预算影响值不超过100万欧元时,德国联邦联合委员会才会放宽对该药物疗效证据的要求。而对于孤儿药,这一指标放宽至不超过5000万欧元。

当前,我国医保目录内共有38种罕见病药物,仅覆盖21种罕见病,但绝大部分罕见病由于各种原因被挡在医疗保障的门外——22种罕见病药物不得不“超适应症”使用治疗,另有17种罕见病药物面临“境外有药、境内无药”的困境。
对已纳入国家医保目录的药物,各地患者的实际个人自付差异也从1%到44%不等,而这对于罕见病高昂的治疗费用来说不过是“杯水车薪”。业界专家呼吁,解决罕见病的医疗费用问题,需要尽快建立一套包括基本医疗保险、大病救助、财政专项基金、社会援助等在内的用药保障机制。
2019年9月,在深圳举办的2019年中国罕见病高峰论坛上,IQVIA中国执行总监李扬阳在演讲快结束时总结道:“我们必须认清一个现实:我国基本医疗保险面临可持续发展的压力,未来对高价罕见病药物的报销决策一定会趋于谨慎。”
一年后的8月6日,IQVIA中国罕见病医疗保障论坛上,同样在演讲结尾,李扬阳谈到,目前各地基本医保报销封顶线的中位值是18万,也就是说,基本医保应当为罕见病支付至少18万/年的报销,如果能够调动各地的大病保险,包括医疗救助、政策性商保、企业慈善在内的多元保障工具,可以使用近45万/年的报销额度。
蔻德罕见病中心创始人黄如方认为,未来各方在设计报销政策时,也应考虑患者的承受能力,不要让患者连支付的初始门槛都跨不过去,继而导致一整套报销政策都无法实际帮助到患者。“很多罕见病治疗费用较高。希望我们的保障体系可以约定患者个人自费的最高金额,而不是报销限额的封顶。”
(作者系《财经》研究员,李泽坤、敖雨璐系《财经》实习研究员)
财健道微信公众号ArtofWealthandHealth



评论