文|火石研究 浅蘅
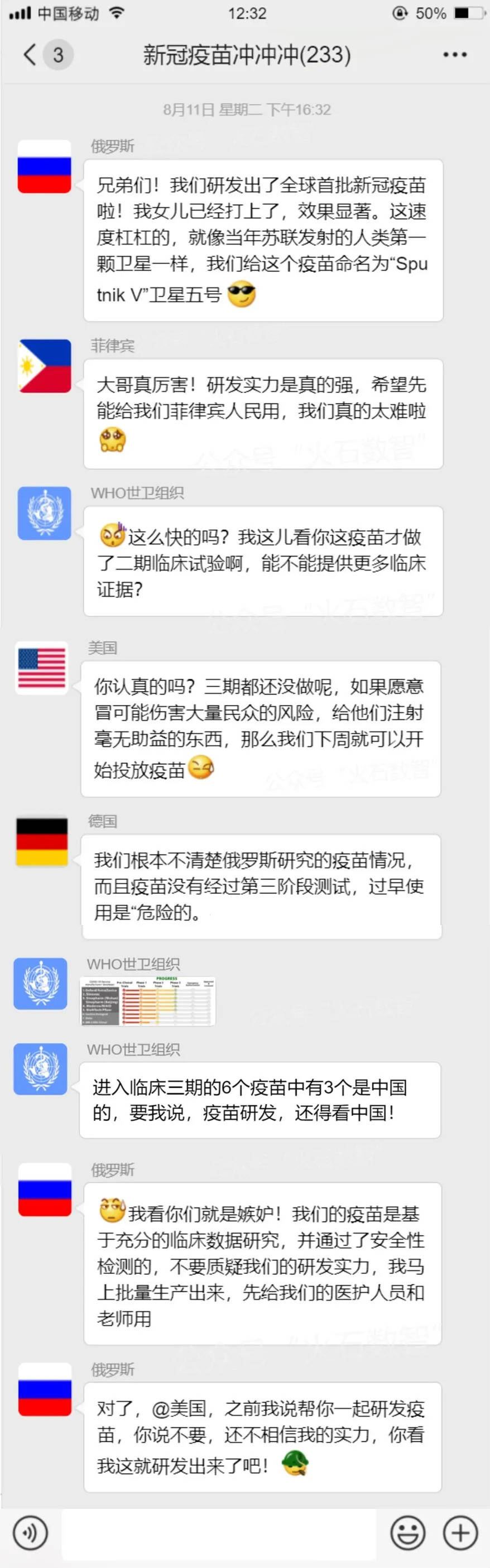
近日,俄罗斯在全球投放了一个爆炸消息,俄罗斯研发上市了全球首批新冠疫苗。
群聊消息来源:国内外媒体报道;制图:火石数智
新冠病毒疫苗赛道一直都广受关注,目前全球约有165种疫苗处于试验阶段,26种进入临床试验阶段,6种已处于III期临床试验阶段,其中3种来自中国。这3种是北京科兴中维的一款灭活疫苗及中国医药集团有限公司(简称:国药集团)的两款灭活疫苗,分别来自武汉生物制品研究所和北京生物制品研究所。还有三种是牛津大学/阿斯利康的腺病毒载体疫苗,美国莫德纳公司的mRNA 疫苗,辉瑞公司/德国BioNTech的 mRNA 疫苗。
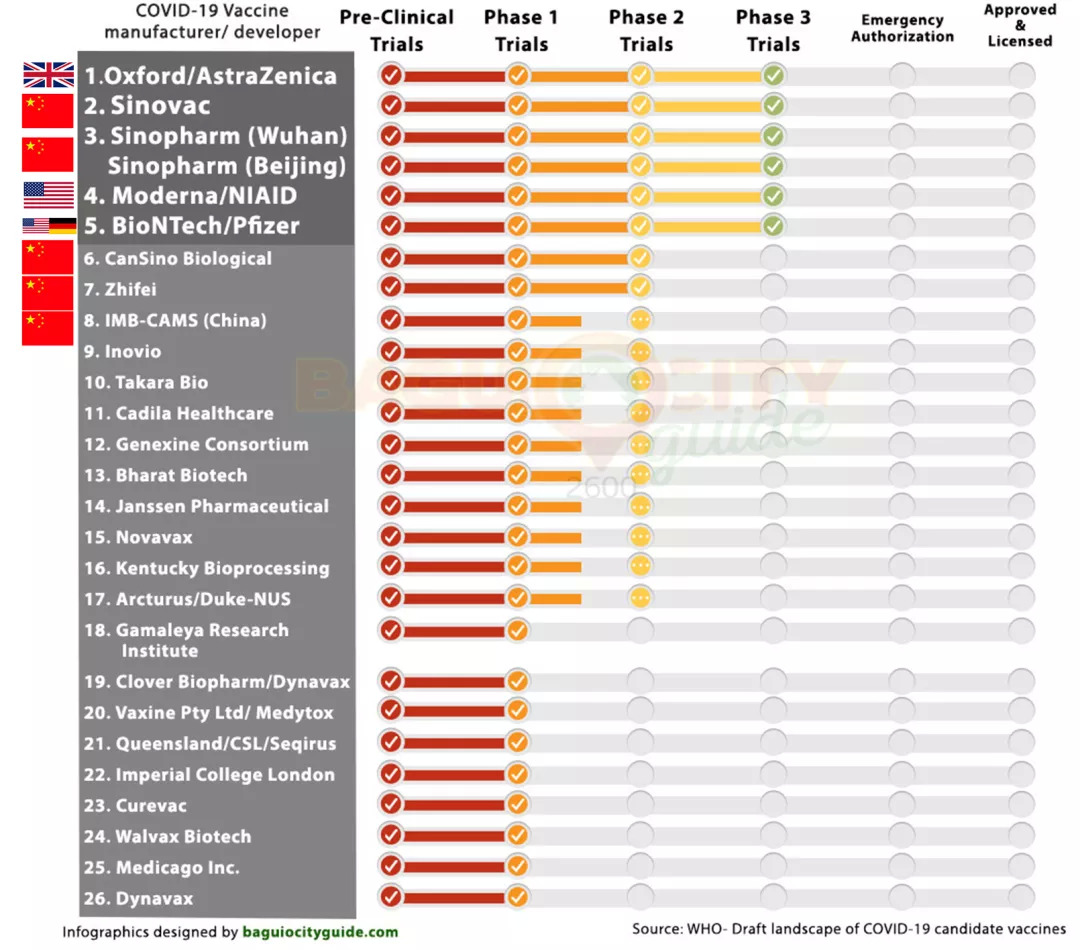
26种研发状态的疫苗种类,前6种是“最有希望成为首批新冠疫苗”的种子选手;图源:baguiocityguide
然而谁也没想到,俄罗斯总统弗拉基米尔·普京(Vladimir Putin)突然于8月11日高调宣布,该国的卫生监管机构已成为世界上首个批准广泛使用冠状病毒疫苗的机构,并且将疫苗命名为“Sputnik V”(卫星五号,向前苏联发射人类首颗人造卫星致敬。),并表示他的一个成年女儿已经接种了疫苗,除了轻微发烧并无其他不适。

这匹黑马是怎么突然出现在赛道的?
世界卫生组织发现上述“卫星疫苗”是正在接受临床评估的疫苗之一,并不在6个“冠军候选”之列,也就是还处于“II期临床阶段”,目前只做了76位受试者的人体试验,还未进行大规模的“III期临床试验”。
这也不难说明为什么俄罗斯刚刚宣布完自己是第一,裁判员世界卫生组织迅速吹哨阻止,这就像百米赛跑,中方选手和西方选手都在赛道上竞速,马上就要到终点了,后面俄罗斯同学跑了50米然后突然欢呼声称自己已经抵达终点。
据美国有线电视新闻网(CNN)消息,当地时间13日,世卫组织总干事高级顾问布鲁斯·艾尔沃德表示 ,关于俄罗斯新冠疫苗,目前还未有足够信息可以做出判断。
美国顶级传染病专家福奇也对俄这款疫苗表示“严重怀疑”。他对美国《国家地理》杂志说:“如果愿意冒可能伤害大量民众的风险,给他们注射毫无助益的东西,那么我们下周就可以开始投放疫苗。”
德国卫生部长12日批评俄罗斯缺乏透明度。“我们对俄罗斯人研究的疫苗知之甚少,”他说,俄罗斯的疫苗没有经过第三阶段测试,过早使用是“危险的”。CNN报道说,俄罗斯于周三开始第三阶段测试,在这之前批准了疫苗注册。
面对国际上的质疑,对此,当地时间8月12日,俄罗斯卫生部长穆拉什科回应指出,这些批评“完全没有根据”。他表示,俄罗斯的疫苗基于充分的临床数据研究,并通过了安全性检测。
有一说一,我们应该如何从科学和理智的角度来看待这件事情?
01、为什么俄罗斯疫苗这么快获得上市批准?
俄罗斯这款名为卫星5(Sputnik V)的新冠疫苗,由加玛丽亚流行病学和微生物学研究所 (Gamaleya Research Institute of Epidemiology and Microbiology)研发,在结束一项不足2个月、仅包含76名受试者的Ⅱ期临床试验后,直接跳过了III期临床试验,申请并最终获得了上市批准。
02、疫苗上市前需要经历哪些流程?
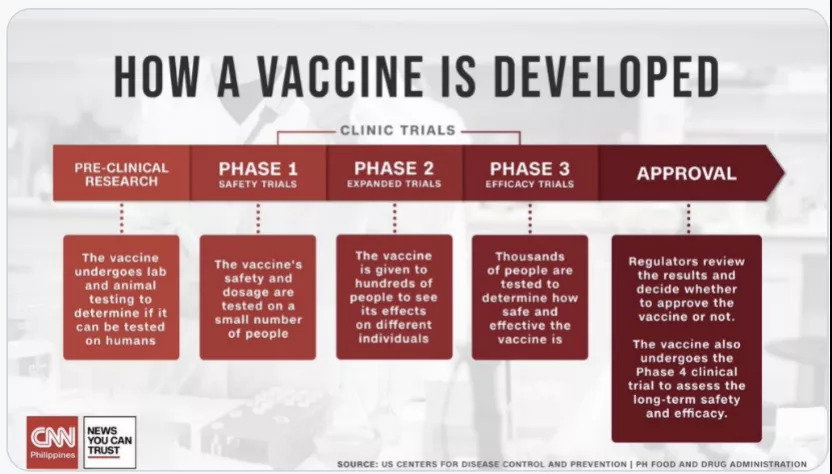
图示:疫苗研发过程;来源:CNN
临床前研究寻找可以诱导抗体产生或细胞免疫的保护性抗原进行疫苗设计,再通过动物实验仔细评价疫苗的安全性和有效性,确认疫苗可进入人体试验。
I期临床试验是人体的安全性试验,找出人体最大耐受剂量及可能产生的不良反应,为确定II期临床试验接种剂量和接种方案提供重要的科学依据;
II期临床试验为有效性初步评价阶段,初步评价疫苗的免疫原性,也为III期临床试验的接种剂量和接种方案提供依据,同时获得更多的安全性方面的资料;
III期临床试验通过更多样本量来获取更丰富的安全性和疗效方面的资料,对疫苗的益处/风险进行评估,为产品获批上市提供支撑。
03、新冠疫苗研发过程中,I/II期临床试验做了什么?
7月20日晚,国际学术期刊《柳叶刀》同时在线发布两篇论文,分别介绍了中国和英国两款新冠疫苗的临床试验成果:一项是由中国工程院院士、军事科学院军事医学研究院研究员陈薇领衔团队研发的重组新冠疫苗(Ad5腺病毒载体疫苗),一项是由英国牛津大学研发的重组新冠疫苗(ChAdOx1腺病毒载体疫苗)。
确认疫苗的安全性:陈薇院士团队发表的临床试验结果显示,受试者接受疫苗注射后,大部分受试者出现的不良反应是轻微或中度的,比如发热、疲劳和注射部位疼痛;低剂量接种人群中只有1%出现3级以上不良反应。牛津大学发表的临床试验结果显示疲劳和头痛是疫苗注射后最常见的症状,其他常见的副作用包括注射部位疼痛、肌肉疼痛、发冷和发烧。两项研究均未发现严重不良反应。从“安全性”看两款疫苗“旗鼓相当”。
确认疫苗的有效性:陈薇院士团队发表的临床试验结果显示,Ad5腺病毒载体疫苗单次接种的第28天,高剂量组95%的受试者和低剂量组91%的受试者均诱发了T细胞免疫反应或抗体免疫反应,为人体对抗新冠病毒感染提供“双重保护”。牛津大学研发的疫苗基于同样的设计思路和工作机理,同样刺激平衡的体液和细胞免疫,临床试验结果显示在第14天特异性T细胞免疫反应达到峰值,91%的受试者产生抗体免疫反应。
确定疫苗接种剂量和接种方式:陈薇院士团队在II期临床试验中采用了两个不同的剂量,结果显示两个剂量单次注射均可以使受试者快速获得体液免疫和特异性细胞免疫,而低剂量具有更好的安全性。牛津大学团队则进一步测试了“双剂保护”的效果,在包含1077名受试者的临床试验中10人在首次注射的第28天接受了第二次疫苗注射,牛津疫苗研究项目首席研究员安德鲁·波拉德教授认为“接受双剂疫苗的10名参与者获得了最强的免疫反应,表明这(双剂疫苗)可能是接种疫苗的好策略。”
04、可以不做III期临床试验吗?
在I/II期临床试验中,只能检测到疫苗是否促使人体产生特异性抗体或免疫细胞,这虽然与疫苗的保护作用相关,但并不是直接的保护证据。只有在III期临床中获得疫苗接种人群感染率明显降低的数据,才能确认疫苗预防病毒感染的效果。
另一方面,疫苗安全性也必须考虑。假设疫苗会导致千分之一的人出现严重不良反应,由于概率太小这些严重的事件在I/II期临床试验中都未能显示出来,那么在II期临床试验后直接批准疫苗上市大规模使用,在基数巨大的使用者中严重的不良反应就会成为灾难。
05、对于研发中的新冠疫苗,临床III期试验需要多久?
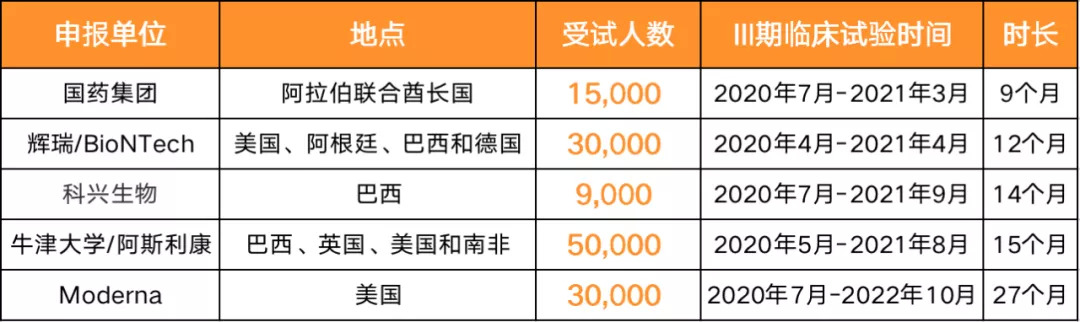
目前进入III期临床的6款疫苗申报的试验时间在9个月到27个月之间,最短的是国药集团的两款疫苗,预计在2021年3月完成III期临床试验,其次是美国辉瑞公司与德国BioNTech联合开发的疫苗,预计在2021年4月结束III期临床试验,历时12个月。科兴生物公司申报的临床试验时长为14个月,牛津大学为15个月,美国Moderna公司则是27个月。
来源:https://clinicaltrials.gov;制图:火石数智
06、为什么临床III期试验要这么久?
已经进入III期临床试验的几款疫苗,预计观察受试人数都以万计。辉瑞/BioNTech预计纳入受试者30000人,Moderna公司30000人,牛津大学/阿斯利康公司50000人,国药集团15000人,科兴生物公司9000人。
筛选合适的病人入组需要时间,观察病人对疫苗的免疫反应也需要时间。
疫苗的临床试验,与动物试验的操作完全不同,不能在接种疫苗之后故意让受试者去接触病毒。所以,临床试验所测试的是在正常的生活状态下感染病毒的概率,只有观察到疫苗组相对试验对照组,即没有疫苗的情况下感染率明显降低,才能确认疫苗的保护效果。因此,需要积累几百人左右的感染者,才有可能观察到疫苗是否具有明显的预防感染的效果,并且估计疫苗的保护率。
需要指出的是,即便试验在几个月内看到了效果,也只能表明疫苗在短期内具有保护作用。疫苗是否具有长期的保护效果?或者疫苗能够维持多长的保护时效?这都需要等待时间的考验。
07、我国的新冠疫苗研究处于什么阶段?
根据世卫组织的信息,目前全球共有165种疫苗处于试验阶段,26种已进入临床试验阶段。进入III期临床试验的6款疫苗中有3款来自中国,分别是北京科兴中维的一款灭活疫苗及中国医药集团有限公司的两款灭活疫苗。
此外陈薇院士团队与希诺康公司联合开发的腺病毒疫苗是第一个进入II期临床试验并发表试验结果的新冠疫苗,目前正与他国就III期临床试验进行洽谈,预期将在8月开展III期临床试验。
除了在疫苗数量和临床试验进度上首屈一指,另一方面我国已具备了大规模量产的能力。根据目前的资料,科兴灭活疫苗的年产能为1亿剂;国药集团在北京生物制品研究所的新冠肺炎灭活疫苗生产车间,有1.2亿剂的年产能,同时在武汉生物制品研究还有1亿剂的产能。
08、结语
那么,我国是如何看待这件事情的?
近日,复旦大学附属华山医院感染科主任张文宏日前在央视新闻《相对论》节目中表示,“针对疫苗‘早产’问题,我们可以不要太过焦虑,再看一下疫苗当中到底哪个最终有效。现在国内的防控模式和防控能力,在疫苗出来之前是可以保障国内经济平稳有序发展的。”
也就是说,不管是哪个国家先一步研发出新冠疫苗,对于全人类来说都是值得庆贺的,但是疫苗要保障“绝对的安全感”。
只有脚踏实地,一步一个脚印的做研发,让科学和事实为疫苗说话,才能真正得到全世界的认可。
参考文献:
1.https://news.ifeng.com/c/7yjgKlhpQ1Y
2.https://news.163.com/20/0807/03/FJD6V78N0001899O.html
3.https://xw.qq.com/cmsid/20200722A06C5800
4.https://med.sina.com/article_detail_103_2_87234.html
5.Pedro M Folegatti, Katie J Ewer, Parvinder K Aley, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet, 2020
6.Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li,et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebocontrolled, phase 2 trial. The Lancet, 2020
策划:Eve
制图:Shelley




评论