文|火石调研 连国强
前言:本篇内容来自火石数智的智能医学内容中心AIMed,AIMed通过收录国内外的医学文献、指南、专家共识等信息,基于AI技术进行智能解析,提取核心内容,转化为高度结构化数据,以支持医学人员高效获取所需的医学内容及证据。
第62届美国血液学会(ASH)年会将于2020年12月5至8日举行,根据ASH年会摘要及公开资料,众多国内企业如百济神州、诺诚健华、亚盛医药、传奇生物等也将在本次大会上亮相,带来各自的创新疗法,本文要介绍的BTK抑制剂即是其中之一。
BTK(Bruton's tyrosine kinase,布鲁顿氏酪氨酸激酶)是一种非受体酪氨酸激酶,它在调节B细胞的存活,增殖,活化和分化中起着至关重要的作用。BTK在B细胞血液系统恶性肿瘤以及几种自身免疫性疾病中大量表达,因此BTK被认为是治疗B细胞恶性肿瘤及某些自身免疫性疾病的潜在靶点。
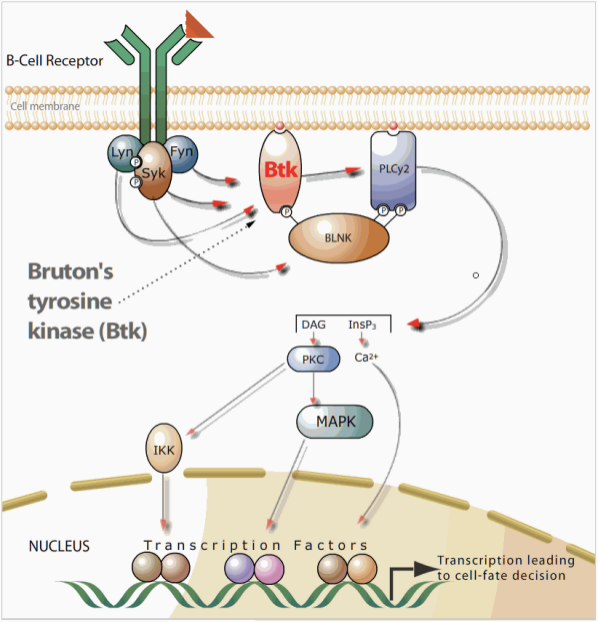
图.BTK信号通路[1]
目前,包括国内的百济神州、诺诚健华等,已有很多企业针对这一靶标开发了BTK抑制剂,上述两家企业在本次ASH年会上分别带来了其BTK抑制剂泽布替尼与奥布替尼的最新临床数据[2]。
泽布替尼是百济神州开发的新一代BTK抑制剂,相比于第一代 BTK 抑制剂,它的选择性更强、脱靶更少、副作用更小,也是首个中国自主研发获得FDA批准上市的抗肿瘤药物。目前泽布替尼已有两个适应症,复发难治性套细胞淋巴瘤(MCL)、复发难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)在国内获批。
奥布替尼则由诺诚健华开发,目前正在中国及美国进行多中心、多适应症的临床试验,研究其作为单药及联合用药的疗效和安全性。奥布替尼用于CLL/SLL和MCL 患者的两项适应症上市申请已经被国家药品监督管理局(NMPA)药品审评中心纳入优先审评。
一、泽布替尼
01
泽布替尼治疗难治/复发边缘区淋巴瘤患者中的有效性和安全性:MAGNOLIA (BGB-3111-214) 研究的初始结果

研究简介:MAGNOLIA是一项单臂、多中心的II期临床研究,主要纳入既往接受过至少一线治疗(至少包括一项CD20单抗相关的方案)的难治/复发边缘区淋巴瘤的成年患者。该研究总共纳入68名患者,中位随访时间为6.8个月。研究结果显示,研究者评估的客观缓解率(ORR)为60%,其中完全缓解(CR)15%,部分缓解(PR)45%,疾病稳定(SD)27%;中位持续缓解时间(DOR)与中位无进展生存期(PFS)尚未达到。在该研究中,有30.9%的患者中断了研究治疗,最主要原因为疾病进展(23.5%)。最常见的TEAE为腹泻(19.1%)、瘀伤(17.6%)、便秘(13.2%)、发热(10.3%)、上呼吸道感染(10.3%)和恶心(10.3%)。
02
BTK抑制剂泽布替尼治疗华氏巨球蛋白血症患者的安全性和有效性的II期临床研究

研究简介:该研究是一项一项单臂、多中心的II期临床研究,主要纳入既往至少接受过一线化疗方案的难治/复发华氏巨球蛋白血症患者。截止2019年8月31日,共入组约44名患者,中位随访18.58个月,数据截止日时中位持续缓解时间(DOR)与中位无进展生存期(PFS)尚未达到。研究结果显示,在43例可评估患者中,研究者评估的主要反应率(MMR,≥PR)高达69.8%。患者耐受性良好,无房颤和肿瘤溶解综合征发生。
03
泽布替尼治疗伊布替尼/阿卡替尼不能耐受B细胞淋巴瘤患者的II期临床研究

研究简介:该研究是一项单臂、多中心的II期临床研究,主要纳入既往不能耐受BTK抑制剂治疗的淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者。截止2020年6月1日,中位泽布替尼暴露时间为3.02个月。研究结果显示,既往发生的31例BTK抑制剂相关不能耐受的AE中,有30例(96.8%)未再发生,1例既往房颤AE由3级降至2级,且持续事件由14天缩至3天。有10例(58.8%)患者发生≥1级AE,2例(11.8%)患者发生≥3级AE,1例中性粒细胞减少,1例晕厥。无导致剂量调整或中断治疗AE发生。在10例可评估疗效患者中,所有患者均获得SD以上的缓解,60%患者服用泽布替尼后缓解深度加深。
04
泽布替尼治疗未经治疗17p-CLL/SLL患者的有效性和安全性:SEQUOIA研究C组的随访结果

研究简介:该研究是一项开放、多中心的III期临床研究,研究C组主要纳入既往未治疗伴17p-CLL/SLL患者(符合治疗指征年龄≥65岁或不适合FCR方案化疗)。截止2020年4月15日,共入组109例患者,中位随访时间为18.2个月。研究结果显示,该研究ORR高达94.5%,PFS、DOR和OS均未达到,预估的18个月 PFS率和OS率分别为88.6%和95.1%。在安全性上,泽布替尼耐受性良好,仅有4例(3.7%)患者由于不良事件停药。
二、奥布替尼
01
奥布替尼单药治疗复发或难治性套细胞淋巴瘤中国患者的长期安全性和有效性:一项多中心、开放性、临床II期研究

研究简介:该研究是一项开放、多中心的II期临床研究,主要纳入复发或难治性MCL患者。截止数据截止日,该研究的中位随访时间为15.0个月。研究结果显示,该研究的ORR达87.9%,DCR为93.9%,PFS、DOR和OS均未达到,12个月 PFS率和OS率分别为70.8%和88.7%。安全性方面,常见的≥3级的AE为血小板减少症,未观察到与治疗相关的≥3级胃肠道和心脏毒性,也未观察到严重出血。
02
奥布替尼单药治疗复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤中国患者II期研究的更新数据

研究简介:该研究是一项开放、多中心的II期临床研究,主要纳入既往至少介绍过1次治疗的复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者。截止数据截止日,共纳入80名患者,中位随访时间为14.3个月。研究结果显示,该研究的ORR为91.3%,CR为10.0%,PR为63.8%。中位PFS、DOR均未达到,12个月 PFS率和OS率分别为81.1%和86.3%。安全性方面,最常见的AE是血液学毒性(包括血小板减少、中性粒细胞减少和贫血)、上呼吸道感染、肺炎和低钾血症。无房颤及继发恶性肿瘤,未发现≥3级的高血压事件,仅有1例≥3级腹泻。
三、结语
随着国内生物医药产业的蓬勃发展,诞生了越来越多的Biotech公司,这一批企业的成长也发展出了一批在国际上都具有竞争力的创新药物,BTK抑制剂即是上述药物之一。相信随着国内药企创新潜力的进一步挖掘,会有越来越多的创新药物展示并参与到国际竞争中去。
参考文献:
[1] Updated Results for BTK Inhibitor Ibrutinib (PCI-32765) Shows Prolonged Progression Free Survival in High Risk, Advanced CLL/SLL and MCL Patients
[2] 2020 ASH



评论