食品药品审核查验中心的官员表示,这个企业名单的制定,是根据《药品GMP跟踪检查计划制定程序》进行的,具体原因包括以下四点。
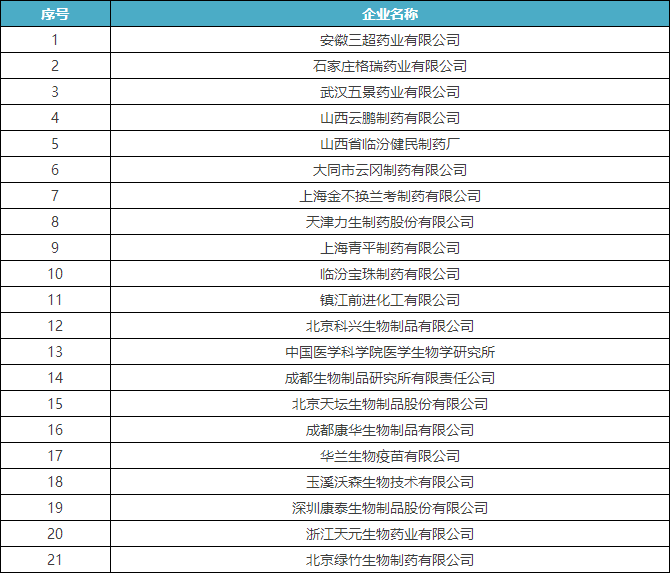
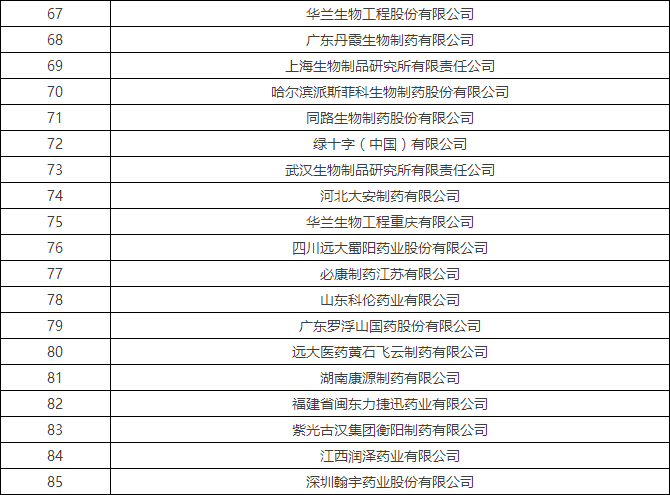
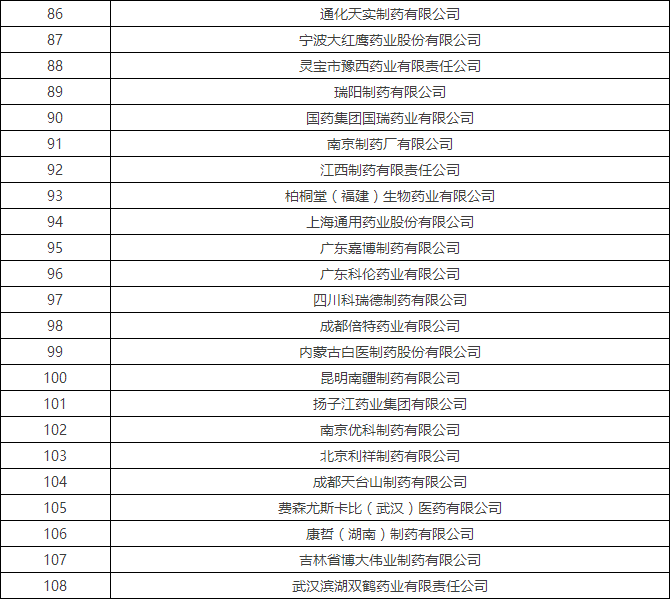
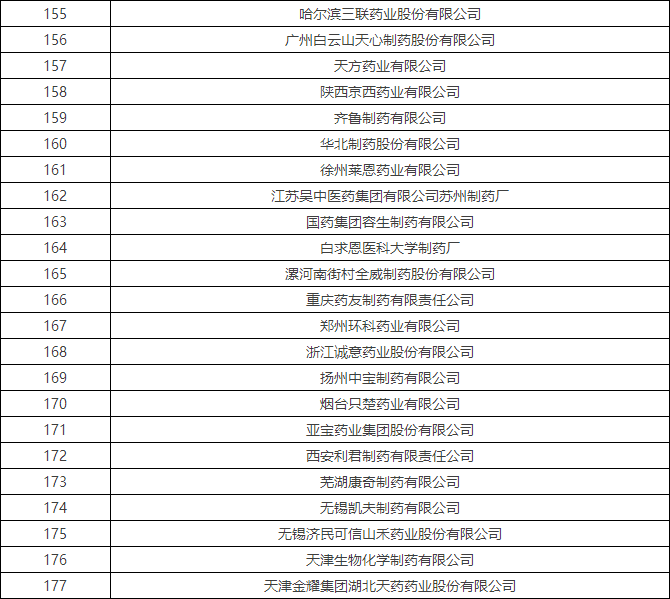
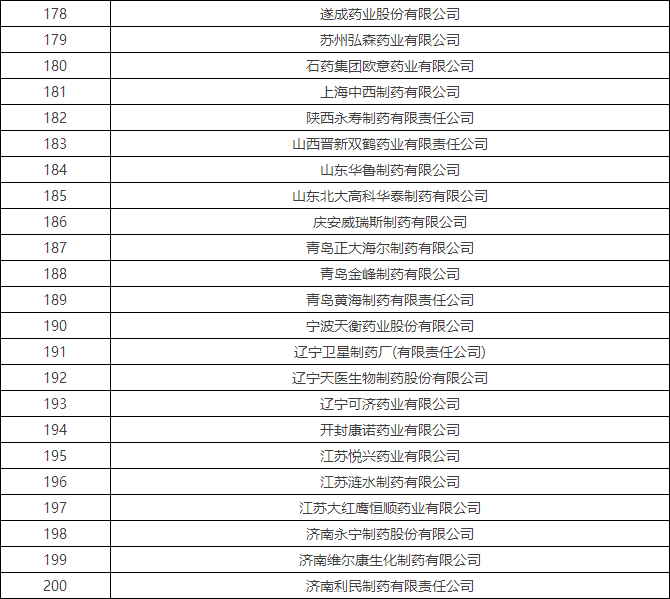
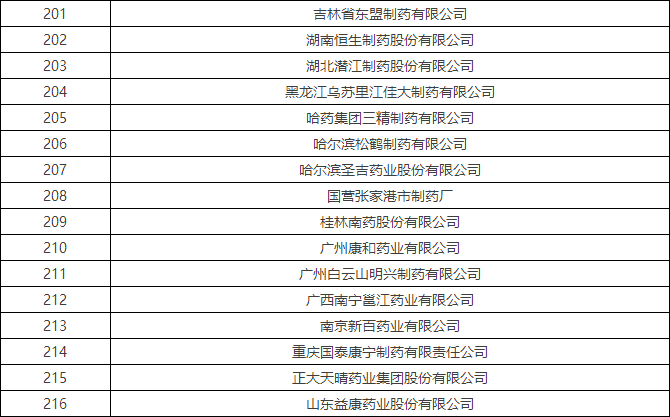
4月初时,国家食品药品监督管理总局食品药品审核查验中心发布了《2016年药品GMP跟踪检查任务公告》,列出了216家企业,称将在2016年对这些企业开展跟踪检查。
这些企业怎么就给“盯上了”呢?
此前,亦有媒体试图回答这个问题。而在第29届中国医药产业高峰论坛,食品药品审核查验中心的官员直接回答了这个问题。
她表示,这个企业名单的制定,是根据《药品GMP跟踪检查计划制定程序》进行的,具体原因如下——
1、根据最近一次认证检查情况进行评估,列入的:
首次未通过,第二次才通过的;主要缺陷超过3项的;期间发过告诫信的;药品注册检查发现有必要进行跟踪检查的;
2、综合分析企业产品情况,有下列情况之一的:
批签发数据异常,由CFDA或中检院提出的;发生大范围严重不良反应,由CFDA或评价中心提出的;药品质量公告中,质量不合格的;发生重大质量缺陷,由CFDA提出的;
3、其他应列入下一年跟踪检查计划的情形:
接到有关信息,药品生产企业可能违反GMP要求组织生产;CFDA有关司局书面提出,要求进行跟踪检查的;
4、疫苗类生物制品生产企业:
每年至少跟踪一次。
除此之外,该官员还透露了哪些企业会被飞行检查。
2015年度飞行检查CFDA共派出检查组47个,涉及58个企业,涉及的范围有中药饮片、中药提取物、中药制剂、化学原料药、化学药制剂、生化药品和血液制品,这也是去年重点检查的企业类型。
至于2016年,虽然目前统计数据还没出来,但该官员表示,无疑力度也是很大的。她还指出,跟踪检查会事先公告,让企业有所准备,而飞行检查则是不会提前通知的。
至于启动飞检的原则,主要包括下面几种:
1、有投诉举报或者其他来源的线索,表明可能存在一些质量的安全风险;
2、检验当中发现了一些存在质量安全风险的内容;
3、药品不良反应监测当中可能存在质量安全风险的。
4、对申报资料感觉有疑问,如申报资料有些数据一看太好了,或者一看就不可能达到的。
5、涉嫌严重违反质量管理规范要求的。
6、企业有严重不守信记录的。
该官员还透露,跟踪检查与飞行检查等的力度会越来越大,其中一个重要原因是无菌药品GMP认证下放。
早在2014年,CFDA法制司负责人在介绍新修订的《药品管理法》内容时,就有“逐步下放和取消药品GMP和CSP认证制度,将认证制度和药品企业准入标准,以及日常生产、经营行为的监管结合,减少审批监管,加强日常监督检查力度”。
为了保证无菌药品CMP认证下放后的日常监督检查力度,该官员表示,今后将建立专职检查队伍,计划队伍将扩充至600人,继续加大跟踪、飞行检查力度;同时,推动检查质量体系,缩小检查水平差异,形成全国监管一盘棋。
附:2016年药品GMP跟踪检查任务




本文来自新康界(XKJ0101)微信公众号,转载请注明出处!



评论