文 | 《财经》研究员 尹莉娜
编辑 | 杨中旭
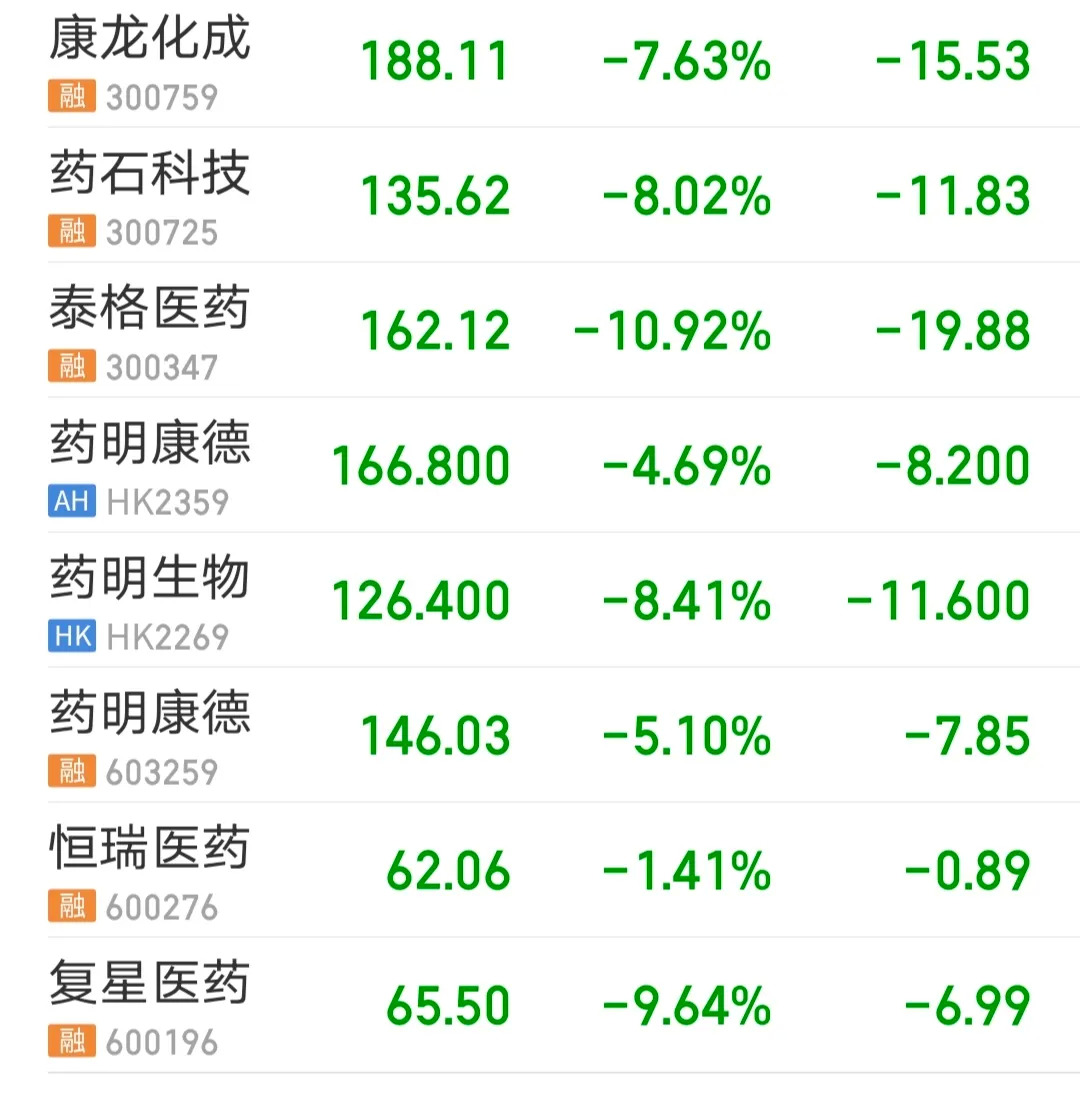
7月2日,国家药监局药品审评审批中心(CDE)下发的两份新政意见征求稿,瞬间搅翻了A股医药板块,生物制药、CXO相关上市公司股价连续三个交易日全线暴跌,政策虽未正式落地,复星医药、药明生物、泰格医药等今日盘中一度跌超10%,而生物医药板块三日跌幅高达8.6%。
这两份文件分别是《以临床价值为导向的抗肿瘤药物临床研发指导原则》和《化学药品创新药上市申请前会议药学共性问题相关技术要求》的征求意见稿,核心内容是要求新药研发“以患者需求为核心,以临床价值为导向”,言下之意剑指眼下国内创新药靶点扎堆、“Me-too”泛滥、低水平重复、缺乏真正的创新等问题。
其中最为“致命”的一条要求是,抗肿瘤药物临床试验应“为受试者提供临床实践中最佳治疗方式/药物作为对照物”,也就是业内常说的“头对头试验”,这好比拳击比赛中,参赛者要直接与拳王PK,成绩不输才能留在场上。
上述将落地的新政,被业内视为继2015年“722审核风暴”后的又一“杀招”,“722审核风暴”针对的是药品大规模数据造假,其直接结果是,超过85%的所谓“新药”撤回申请。时任国家食药总局局长毕井泉以此为发端,极大地推动了国内创新药的跨越式发展,并对整个行业与国际接轨做出了历史性贡献。
所谓Me-too药,是在原研药基础上,再研发(改造)一款接近的药物。过去数年间,这一操作在中国被发挥到了极致,其作用机理、适应症不变,只对分子结构做轻微变动,就能规避专利。
趣学术CEO张瑞表示,在集采将仿制药价格大幅压低之后,药企没有研发就没有出路。问题是,中国绝大多数企业没有技术和资金实力去做“First in class”,Me-too药就成了众多创新药企的无奈选择。
药智网数据显示,到2020年,化学创新药(1类新药)注册获批达835个(平均一个品种有2个受理号,即相当于400多个新药)。业界戏称,新药已经不是Me-too(你有我也有),而是We-too(你有,我们也有),每当一个全新的药物出来,就有一堆的企业去跟风。
业内权威人士向财健道表示,此次新政意在“鼓励真正的创新。”目前,意见稿给出一个月时间向社会征集反馈,而一旦其真正落实执行,可能引来整个医药行业大变天。
01、新药研发“头对头”PK,国内至今仅个位数成功
在药物研发的对照试验中,根据需要,可选择安慰剂、阳性照药或最佳支持BSC治疗(Best Support Care)作为对照。
安慰剂是没有药物治疗作用的药剂,阳性药物一般即传统疗法,如癌症的化疗疗法,BSC则是现有手段中最好的治疗方法,也就是常说的“头对头试验”。显然,三种对照试验难度逐步升级,BSC的所需成本更显著提高。
过去,国内新药仅极少数选择BSC试验,比起与先前进入市场的外企巨头药物正面对决,选择前两者的效率更快、成功率也更高。据财健道不完全统计,2010年以来的公开报道中,国内新药开展与原研药“头对头试验”的不超过10款,挑战成功(安全性、治疗效果等不输于对照组)的更在少数。
但此次意见征求稿中直接提出:“应尽量为受试者提供临床实践中最佳治疗方式/药物,而不应为提高临床试验成功率和试验效率,选择安全有效性不确定,或已被更优的药物所替代的治疗手段。”

根据意见征求稿,只有当某一适应症在临床中没有准确的治疗标准时,才能选择使用安慰剂作为对照。否则,“即使临床试验达到预设研究目标,也无法说明试验药物可满足临床中患者的实际需要,或无法证明该药物对患者的价值。”
也就是说,一旦新政落地,那些仍在扎堆开发中的“Me-too”药物,如果适应症与已经上市药品重合,将不得不进行“头对头试验”并获得积极结果,才有上市机会。
以近年来最为火爆的PD-(L)1抑制剂为例,目前默沙东的K药(帕博利珠单抗)在国内已经有七个适应症获批,赛默飞的O药(纳武利尤单抗)、阿斯利康的I药(度伐利尤单抗),以及国内先行者恒瑞、百济、君实、信达等各家产品也有2-4个适应症上市,肺癌或者黑色素瘤等大适应症基本已被广泛覆盖。而国内PD-1研发者近百家,后来者可能必须与前述产品正面较量,才有可能进入市场分一杯羹。
除了专业药学问题,CDE还要求企业必须讲清楚产品的商业化差异,换言之,如果没有商业化差异,申请仍然很难获批。

国内创新药企所遭受的这一“打击”,日企也曾经历。1992年之前,由于创新药企内卷,日本药企放弃Me too策略,走差异化研发之路,最终催生了武田制药、安斯泰来等big phrama,其现已跻身全球跨国巨头之列。
CDE研发新政正在加速中国药企的这一进程。
02、CXO行业受重挫,创新药“卖水人”前景几何
自上周五意见稿发布后,以药明康德为代表的CXO公司在二级市场首先“领跌”。市场认为,“伪创新”泡沫一旦击破,首当其冲的便是医药外包服务行业。
医保外包服务包括CRO(临床前或临床研究外包)、CMO/CDMO(药物生产外包)以及 CSO(药物销售外包),它们随着美国的创新药行业快速发展,因跨国巨头药企为降低成本而诞生,因此在国外CXO订单主要来自大药企。
但在中国创新药现今的发展阶段,大药企如恒瑞、百济等却不约而同地选择了自建团队,将研发和生产掌握在自己手中,拒绝与CXO企业合作。
虽然在过去几年,中国CXO市场增速高达两位数,但订单来源以中小企业为主,这和近年来VIC模式的火热密不可分。风险投资(Venture Capital)+知识产权(Intellectual Property)+合同制研发服务机构(CRO)三者结合,有钱、有海归研发人员、有外包商,就能“攒”起一家创新药企业。
这一点从行业龙头药明康德近年来的客户变化中可窥见一斑。2016年到2020年H1,药明康德全球前20大制药企业客户占公司总收入的比重,从40%下降到31.9%,降幅接近10个百分点;而中小客户贡献收入的复合增速达到34%,2016年是36亿元,三年后的2019年已达到86.7亿元。
为了迎合中小企业蓬勃的市场需求,药明康德提出“长尾战略”,不断促进中小型生物技术公司、虚拟公司和个人创业者等“长尾”客户的CRO和CDMO/CMO合作。药明康德副董事长胡正国2019年在接受媒体采访时也曾直言不讳地谈到,长尾战略是公司未来发展的重要举措。
此前,对于CXO行业景气度持续多久的问题,业内已经多有讨论,此次CDE新政意见稿发布,更令业内关注。有券商分析认为,新政实则将促进临床试验成本增加,外包渗透率长期有望转而提升。东吴证券研报指出,更新的研发方向,更多以BSC做对照的临床试验等将增加药企临床试验的成本,对新药研发中的临床试验设计与患者招募提出更高要求,长期来看头部CXO企业将因此受益。
03、创新药政策收紧,倒逼产业向“Me-better”转型
VIC模式的火热催生了CXO行业的快速发展,也使得“license in”(产品引进)风靡中国药界。资本助推下,这一模式快速引进早期管线,利用成熟的CRO和国内规模庞大的患者群,快速推进临床和商业化,再谈判进入医保目录。当Me too变成We too,诸多所谓“创新药企”,实质上只是为了快速套现。
如此一来,国产创新药从原来的个位数,开始变成向药监局批量申请。问题是,无论是靶点还是医保资金,都有天花板。
两个月前,美国FDA针对当前研发火热的双抗类药物发布了《双特异性抗体研发指南》,其中强调,如果同靶点单抗已经上市,则必须进行头对头试验,对比疗效与安全性,以便更有效地进行患者获益和风险评估。
这一指南的内容与CDE7月2日意见稿释放了同一信号,无论在中美哪一市场,更高质量、更具创新性的药物才是未来研发主流,政策收紧下,将倒逼制造企业从“Me-too”到“Me-better”转型,挤压行业“伪创新”泡沫破碎。
虽然短期内资本市场对于生物医药行业出现消极情绪,但从长期来看,就像6年前的“722审核风暴”一样,此次政策对于中国创新药产业发展系重大利好,正如业内权威人士向财健道表示,这是在“鼓励真正的创新,”为了让专业监管更有力度,“药审中心应该做大做强。”



评论