文|青眼 小鱼
2021年的最后一枪,瞄准了“械字号”。今日,国家药监局发布“第一类医疗器械产品目录的公告(2021年第158号)”,明确品名举例方面删除“医用冷敷贴、冷敷凝胶”等,同时公布了禁用成分目录。
这意味着,第一类医疗器械不能再叫“医用冷敷贴”。并且,相关第一类医疗器械也不得添加中药、天然植物及其提取物等成分。
第一类“医用冷敷贴”被禁
2020年初,国家药监局给所谓“医美面膜”“械字号化妆品”定性,指出不存在“械字号面膜”。由于所谓“械字号化妆品”主要是第一类医疗器械,常见产品为“医用冷敷贴、冷敷凝胶”等,自国家药监局发声后,全国范围内对“第一类医用冷敷贴”等医疗器械展开拉网式整顿。

今天,随着上述公告的发布,第一类医用冷敷贴是彻底凉了。根据今天公布的《第一类医疗器械产品目录》(下称《一类目录》),国家药监局对2017版目录中“09-02-03 物理降温设备”第三个条目的产品描述、预期用途和品名举例均进行了规范和修改,在预期用途方面限定其为“用于发热患者的局部降温。仅用于体表完整皮肤”,在品名举例方面删除了“医用冷敷贴、医用冷敷头带、医用冷敷眼罩、冷敷凝胶”。

同时明确,该类产品备案时,应当直接使用目录中的“品名举例”名称(如医用退热贴、医用冰袋、医用冰垫),产品描述应当详细列明产品具体组成成分,预期用途不应当超出目录规定的预期用途。国家药监局表示,此举意在进一步规范此类产品备案,净化市场环境。
此外,国家药监局还删除了液体敷料、膏状敷料有关内容。即非无菌提供、通过在创面表面形成保护层,起物理屏障作用,用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理的液体、膏状敷料未纳入新《一类目录》。
众所周知,近年来“医美面膜”“械字号化妆品”横行网络,混淆消费者视听,也给化妆品行业带来不小的伤害。因此,对于封杀“第一类医用冷敷贴”的做法,行业人士一致拍手叫好,“是该这样,否则化妆品面膜太卷了”“良币会多了”。
不过,在第二类和第三类医疗器械中,企业仍可使用医用冷敷贴的品名,但比起第一类实行备案管理,二类和三类采取注册制,门槛和监管更为严格,“二三类会规范很多,拿证的时间和成本高,监管更严”,某业内人士向青眼介绍。而且从现有国家药监局注册的信息来看,二类三类医用冷敷贴少之又少。从这个层面来说,医用冷敷贴基本上是要成为过去式。
这些成分被禁用
此次《一类目录》的修订,还特别规定了禁用成分目录。
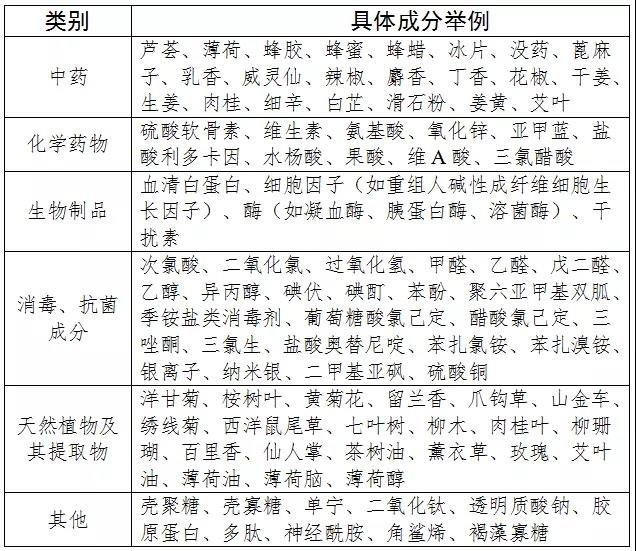
根据规定,“09-02-03物理降温设备”“09-03-08光治疗设备附件”“14-10-02创口贴”“20-03-11穴位压力刺激器具”中的产品不能含有中药、化学药物、生物制品、消毒和抗菌成分、天然植物及其提取物等发挥药理学、免疫学、代谢作用的成分或者可被人体吸收的成分,包括但不限于下表所列成分。
国家药监局还强调,备案时在产品描述项下应当详细列明产品的具体组成成分,不可使用“所含成分不具有药理学作用。所含成分不可被人体吸收”或者类似笼统描述。
对比此前的意见稿,青眼发现正式文件中的禁用成分数量有所增加。譬如在中药、化学药物类别中,新增了艾叶、水杨酸、果酸、维A酸等成分;在天然植物及其提取物类别中新增了薄荷油、薄荷脑等。
尽管有业内人士对禁用成分目录存在一定争议,认为“这种目录会暗示其他原料可以用,药监局就需要不断更新这个目录,更容易引起争议”。但从另一个角度来看,无疑是堵住了医疗器械违规违法添加,以化妆品冒充医疗器械去备案,以医疗器械充当化妆品售卖的漏洞。
4个月过渡期
据了解,自2022年1月1日起,第一类医疗器械均应当按照新《一类目录》实施备案。也就是说,从明天开始,一类器械再无“医用冷敷贴”。
而对于此前备案的产品,国家药监局也给出了过渡期。即2022年1月1日前已完成备案的产品,其中如按照新《一类目录》产品仍作为第一类医疗器械管理、但备案信息表中登载内容及备案的产品技术要求有关内容与新《一类目录》不一致的,备案人应当于2022年4月1日前完成备案信息变更,或向原备案部门提出取消原备案、重新办理第一类医疗器械备案。
仅以“医用冷敷贴”为例,青眼在国家药监局国产医疗器械产品备案平台搜索有2000多条记录。也就是说,这些产品要及时变更或注销重新备案了。
国家药监局表示,此次《第一类医疗器械产品目录》修订编制,是结合了第一类医疗器械产品备案中发现的突出问题,听取相关专家意见,对目录逐条核对梳理、技术研判、查漏补缺。这表明,对于行业存在的问题,监管也始终与时俱进,在“放与管”之间找到平衡,推动行业朝着正确的方向发展前行。




评论