文 | 财健道 杨燕
编辑 | 杨中旭
原料药在医药行业的角色并不讨喜。
创新药、仿制药、中药在资本市场轮番上演潮起潮落,风云争霸实录的时候,原料药市场很多时候是连正脸也不会露出的幕后配角甲乙丙丁。
但作为绝大部分药品的上游,原料药端的变化对下游制剂产业往往具有“卡脖子”的连锁效应。近年来,多款原料药价格更是“打着滚儿翻着番儿”地上涨,下游连连叫苦,制剂厂商因原材料上涨而导致的断供时有发生,患者成为最终的受害者。2021年11月,国家反垄断局挂牌的第一天,即出台《关于原料药领域的反垄断指南》,震动市场,也意味着原料药行业迎来“最强监管”时代(详见《原料药垄断20年》)。
包产与包销,以及形成价格联盟,是原料药垄断最常见的几种方式。通常,市场份额过大,亦有垄断之嫌。一位资深医药行业从业者李志伟在读完《原料药垄断20年》后告诉《财健道》,他曾与一家垄断了市场九成以上份额的药企展开角逐,并败下阵来。
对他和他的合作伙伴而言,是投资失败,对手是细分领域的“垄断药企”,但他又输得很服气,这家“垄断药企”赖以获胜的本钱,并非是超高份额的市场垄断地位,而是全球药企在这一细分领域都难以企及的工艺优势,甚至,这家国内的药企巨头还把这款仿制药及相关原料药的全球药典标准,牢牢地把握在了自己手中。

“对我来讲,结局很苦涩,”时至今日,李志伟在谈及此事的时候,依旧五味杂陈,“即使它是垄断,医药主管部门也会喜闻乐见,工业细分种类那么多,中国能站在全球之巅的很少,这促进了药学的发展。”
这家把李志伟打服了的国内药企,是齐鲁制药。而这个非典型的原料药垄断案例,煞是精彩。
01 药品上市,许可持有人的如意算盘
2017年,MAH(药品上市许可持有人)制度开始实施,上市许可持有人和生产许可持有人可以分离,这让获得药品批准文件的主体由药品生产企业扩大到了药品研发机构和科研人员,在鼓励研发的同时,有利于确保和提升药品质量。
在那一年,李志伟一位朋友买了家药厂,当时厂子里囤积着一批药品批文,资源有限,两人决定盘点下哪些产品有复产前途。
通常,MAH持有人会瞄准10亿市场份额的单品。份额过大,中小药企hold不住;份额过小,那点儿利润不值得。
但是,李志伟和朋友选中了全国范围内仅有3.2亿销售额的小品种:艾司洛尔。
这是一款非常典型的仿制药,已经上市十多年,主要用在急救和麻醉上,起效快,作用时间短,可以很快的把血压降下来,属于医保甲类目录产品。而且,它半衰期很短,也就是说,它行使完治病救人的“职责”后,就不再发挥作用。有些同类药品则做不到这一步,如果半衰期长,患者会在很短的时间内从高血压变成低血压,生命又会垂危。
当时,一支艾司洛尔注射液大概是20-30元/10ml,实际使用的时候往往一敲10支,一次就是两三百元的使用量。
艾司洛尔原料商给出采购价格出来后,李志伟算过一笔账,生产成本加上保险费,环评,代理商销售提成等等,复产后毛利率能保持在350%左右。
2017年的时候艾司洛尔一年总销售额在3.2亿左右,每年增长的趋势也比较明显,临床刚需,销量稳定,毛利率比较高,市场上竞争者也比较少。虽然市场总量不大,各项指标都很好,利润确定,这是一款小而美的产品,一笔值得做的生意。
李志伟跟朋友调研了这款产品的行情,艾司洛尔在国内有20多家有批文的原料生产商,10家左右的制剂生产厂,但是真正在生产的厂商并不多,只有两三家,行业集中度非常高,齐鲁制药一家就占快97%的市场份额(2017年)。
一个不能忽视的背景是,恰逢一致性评价和带量集采政策出台,医药行业面临大洗牌,此前没有市场份额的仿制药产品只要通过一致性评价,就有进场一搏的机会,光脚的不怕穿鞋的,也就是行业内俗称的“光脚药企”
这是李志伟一项不小的优势。带量集采政策没出台那些年,处于垄断地位的公立医院说一不二,药企为求“入院”,一笔或达数百万元的“入院费”是免不了的,也就是说,“穿鞋”药企在获客阶段,付出了巨大的沉没成本。
带量集采因为转弯过急,一直为业界所诟病,但一项巨大的好处,是集采中标者,即可在各家医院免费开户,“光脚药企”省去了巨大的沉没成本,如果能够通过一致性评价,就有了入围集采分一杯羹甚至垄断市场的机会(详见《光脚药企三年沉浮》。
李志伟盘算着,通过一致性评价后,即使只能分到艾司洛尔10%的市场份额,对于一家刚复产的药厂来说也非常安逸了。
02 齐鲁登场,国际标准碾压国内标准
转折总是来得猝不及防。
作为艾司洛尔上市许可持有人,2018年,李志伟和朋友找到一家有资质的原料药代工厂,投入了40多万元,前期试产了小半年,各方面准备齐全,双方准备大干一场的时候,发现了一件事。
一致性评价指的是仿制药和原研药必须满足“管理一致性、中间过程一致性、质量标准一致性等全过程一致”的要求。
国内现行药典(2020版)关于艾司洛尔的杂质,有着如下规定:

国内的杂质标准是在1%之内,李志伟找的原料药厂厂检报告能做到控制在0.8%以内,这也是他敢于冲进这一市场的底气。
但他当时始料未及的是,游戏规则发生了变化。
这款产品原研厂家是百克顿公司,它在中国已经退市,国外也不再生产这款产品,在无原研可参照的情况下,想做一致性评价,必须参照最新的参比制剂。

一路顺藤摸瓜,李志伟在美国药典上发现一个此前没注意的变化。2019年的美国药典上,艾司洛尔的相对标准偏差系数(通常用于检测工作中分析结果的精密度)要求从控制在2%之内调整到了0.73%。杂质种类也从控制2个指标变成了6个指标。
换算成对杂质的要求,就是从原本的控制在1%之内调整到了0.3%之内。
李志伟分析,这是国内的竞争对手所为,最终在美国第43版药典上,将其标准从1%提升至0.3%!
“他把整个杂质降到0.3%,纯度太高了,这太可怕了。”李志伟说。
制剂的标准如果是1%,原料必须达到0.8%,因为原料溶水之后,会释放出杂质。李志伟的代工厂“努力再努力”,“再结晶”,原料顶多做到0.7%。
如果要按照美国药典的制剂标准0.3%来做,原料标准必须达到0.2%。
与此同时,齐鲁药业的艾司洛尔一致性评价已经在路上了。如果这是一场同台竞争,齐鲁打出了明牌,力所不逮的李志伟只能放弃。
显然,艾司洛尔美国药典标准比国内现行药典标准更高,一致性评价“就高不就低”。
2021年8月,齐鲁制药旗下的盐酸艾司洛尔注射液通过一致性评价,是国内这一品种第二家过评的产品。
米内网数据显示,2020年艾司洛尔注射剂终端销售额超过7亿元,同比增长24.75%。其中,齐鲁制药占据94.4%的市场份额。
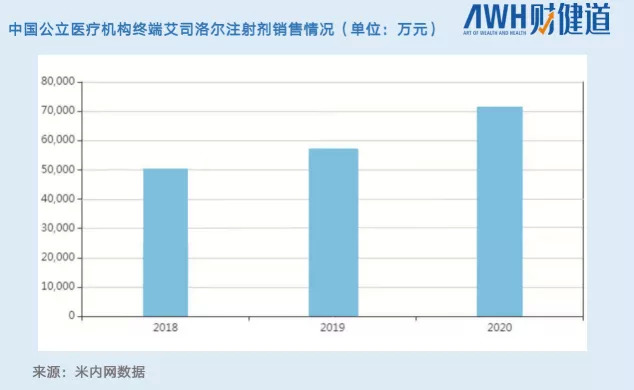
化药利润高。在李志伟早期的模型里,艾司洛尔3.2亿的市场,能产生超过1个亿的利润。如今市场扩容到7个亿,且技术标准在10年内很难被超越,齐鲁制药在这一品种上的利润,令人艳羡。
03 从大到强,一流的企业做标准
这几年间,不时有朋友跟李志伟打听,哪些仿制药值得做。李志伟仍然坚持看好艾司洛尔,但是在无法找到能稳定提供满足生产标准的原料药之前,新入局者显然只能望洋兴叹。
回过头来复盘自己从布局到匆忙退场的整个过程,李志伟发现,当时主要是遇到了三个拦路虎。
第一个就是原料供应,对于市场集中度非常高的品种,国内原料药供应商也趋于集中,当时他们在上海的原料药博览会问了一圈,国内很少有做艾司洛尔原料药的,除非你先下订单,对方从头开始研究工艺。
第二点是环境污染。为什么全国近十家企业突然都不生产这款产品了,其中一个原因就是这款产品生产过程中污染比较大,很难处理(头几年的“环评风暴”将诸多中小原料药厂挤出市场)。
第三点就是原料技术,也可以看做是质量标准。国内原料药企业技术更新缓慢,在美国药典把艾司洛尔的杂质标准从1%拉高到0.3%之后,其实对后来者设置了一个很高的技术壁垒,现有工艺很难实现这个跨度转变,除非做深入的工艺优化。
不久前,李志伟的一个朋友在浙江找出了一家原料药企——火车头,主要做原料药外贸,可以提供满足新药典的艾司洛尔原料药。
但摆在李志伟面前的又一个难题是,如果更改了原料供应商,那么从变更到生产之间整整多出了两年左右的时间,在齐鲁制药等企业已经过评的情况下,双方的差距无疑在一步步拉大。
这背后同样折射出医药行业的另一重门槛设置,对于细分专业领域来说,技术的积累和供应链的打通往往并非一朝一夕就能实现的。
看上艾司洛尔这款仿制药的并非只有李志伟一个,另一位药企负责人试图通过从国外进口原料药来实现稳定供应,找了一圈之后发现,目前能达到新药典标准的原料药提供商暂时只有齐鲁制药和火车头两家。
标准提高后,这一市场格局也被固定下来,此局难解。
李志伟自嘲,“虽然较量输了,但是输的心服口服,拉高标准这件事,无论从监管的角度还是为患者考虑的角度,都是好事,更何况是中国药企做到了这一点”。
在这点上不得不佩服齐鲁制药,他们在仿制药的工艺上的确有优势。
以无菌注射液邦达为例,日本药典要求其有效期内含水量不得超过0.6%,已经是全球最严,但是日本进口商往往会在这一标准上继续加码,要求这一数字不超过0.2%,为了攻克这个难题,齐鲁专门对厂房进行了改造,增加相关设备,专设生产线,最终实现无菌注射剂对日出口。
在化学仿制药领域,原料药的重要性不言而喻。
根据专利、产能、运用广泛程度、需求稳定性等特征,化学原料药可分为大宗原料药、特色原料药和专利原料药三种。
按照产品附加值和进入壁垒划分,排名大概是专利原料药>特色原料药>大宗原料药。
一直以来,欧美国家凭借研发、知识产权、生产工艺等多方面的优势,在专利原料药领域占据主导地位,而中印则依靠成本优势成为大宗原料药和特色原料药的主要供应商。
作为原料药的生产大国和出口大国,目前中国大宗原料药的出口能占到世界原料药市场份额的20%左右。国内原料药市场的国产替代同样是从业人员一直关注和期待的。
从研发生产到患者服用,药品质量控制有相当复杂的流程。
还是以齐鲁制药为例。2020年,中国药监局将齐鲁制药旗下奥沙利铂注射液200mg/40mL(适用范围: 直肠癌、转移性结直肠癌)公示为国内仿制药参比制剂。这款注射液早在2016年就被FDA认定为美国的同类型仿制药参比制剂,也是目前国内唯一被认定为参比制剂的药物。
一位原料药行业资深从业者告诉《财健道》,各国药典更新频率基本都保持在5年修订一次的范围。药典修订期间会组织相关专家对各类标准进行研究,一般三种情况会出现标准改变的情况。一是行业技术突破,企业能够达到更好的标准,二是原研药此前有杂质或副作用,需要优化,三是医生端对某些药品提出需求,企业又能做到,那么药典就会更新。
在其看来,药典上的标准可以视为一个行业下限,企业实际上可以做的更好,此前原料药行业较为封闭,制剂端没有高标准,原料药企出于成本的考虑,往往没有动力去做技术突破。
如果中国原料药行业想要完成从大到强的转变,类似于艾司洛尔这样的案例颇多可取之处。
尤其是在MAH制度推出后,完全可以和外部实验室以及一些CRO公司合作进行技术升级,这样才能吃到“头啖汤”。
中国的一致性评价风格上其实更偏向于日本。对仿制药的要求是跟原研药一样,甚至比原研药表现还要好。这就要求药企的产品工艺水平和质量标准不能再瞄着国内,而是要在国际上领先。
三流的企业做产品,二流的企业做品牌,一流的企业做标准。“比照着欧洲和美国的药品生产规范找差距,甚至超越他们,我们自己制定标准,这样的案例越多越好。”输掉艾司洛尔这局棋的李志伟,并没有忘掉做强中国制药工业的初心。
(作者系《财经》研究员)




评论