记者 |
首款国产新冠口服药似乎渐行渐近,在究竟谁能拔得头筹的猜测中,相关概念股的炒作此起彼伏。
针对“河南真实生物的新冠口服药阿兹夫定即将揭盲,华润双鹤将与河南真实生物签署代理生产、销售协议”的市场传闻,4月19日晚,华润双鹤(600062.SH)发布公告辟谣称,“截至目前,公司并未与河南真实生物达成相关协议“。
有意思的是,此次被专家“认定”的新冠特效药阿兹夫定,实际上是用于治疗艾滋病的“老药”新用,目前仅在中国获批上市,尚未获批用于新冠病症。不仅如此,在关于阿兹夫定片多个公示的国内临床实验中,记者并未发现有关新冠治疗的实验目的,且上述临床试验均显示“尚未招募”。
艾滋病“老药”新用
华润双鹤所辟谣市场传闻,缘起于近日由中国医学科学院主办的第二届“中国医学发展大会”。

大会上,中国医学科学院学部委员、中国工程院院士蒋建东重点报告了“阿兹夫定“在治疗新冠适应症上的研发情况和进展,称该药物治疗新冠轻重症都非常有效。”
据蒋建东介绍,患者口服阿兹夫定后3-4天核酸转阴,平均用药时间6-7天,平均9天出院。此外,阿兹夫定对多日用其他药物无效的病人同样有效,且与其他新冠药物不同,阿兹夫定对重症与轻症患者的治疗效果相似。

据悉,阿兹夫定治疗新冠攻关组由河南真实生物科技有限公司(下称“真实生物”)主持,中国医学科学院负责药理、药效和药代研究。其中,中国医学科学院院长王辰院士负责临床研究,北京地坛医院、武汉中南医院等10多家医院参与其中。
蒋建东在报告中表示,“2020年2月,阿兹夫定被发现可以抗新冠病毒;同年4月被SFDA批准抗新冠三期临床试验;目前,三期临床已经结束,俄罗斯和巴西结果已经报批。”
在此背景下,有市场传闻称,真实生物的阿兹夫定目前极可能成为国内首个获批小分子新冠特效药物,而作为真实生物的医药流通代理,华润双鹤首当其冲将从中获益。
值得一提的是,此次被作为新冠特效药物的阿兹夫定,实际上是治疗艾滋病的“老药”新用。
界面新闻注意到,阿兹夫定(Azvudine)实际上是一款由郑州大学和河南省分析测试研究中心研制的治疗艾滋病的药物,由河南师范大学教授常俊标率领团队研制成功。2021年7月已获附条件批准上市用于治疗HIV,成为我国首款真正拥有自主知识产权的抗艾滋病病毒的药物。
从药理来看,阿兹夫定属于脱氧胞苷类似物,是新型核苷类逆转录酶和辅助蛋白Vif抑制剂,其作用机制主要是能够选择性进入HIV-1靶细胞外周血单核细胞中的CD4细胞或CD14细胞,作用靶点主要有Vif、RT、RdRp、NS5B polymerase等,发挥抑制HIV、HCV、EV71等多种RNA病毒复制的功能。
在作用机制方面,阿兹夫定与日本盐野义特效药和美国辉瑞特效药PAXLOVID显著不同,但其作用于Rdrp的机制与君实、默沙东相似。
拓新药业(301089.SZ)此前在回复深交所关注函时表示,阿兹夫定原料药是与阿兹夫定片关联审评的产品,阿兹夫定片目前仅用于治疗艾滋病(HIV),其他适应症尚不明确,阿兹夫定片仅在中国获批上市,未在中国以外的其他国家或地区获批上市。
同时,阿兹夫定相关专利由其药品上市许可持有人真实生物持有,公司子公司仅具有生产阿兹夫定原料药的资质与条件,阿兹夫定相关专利权人有权授权其他厂家生产阿兹夫定原料药。
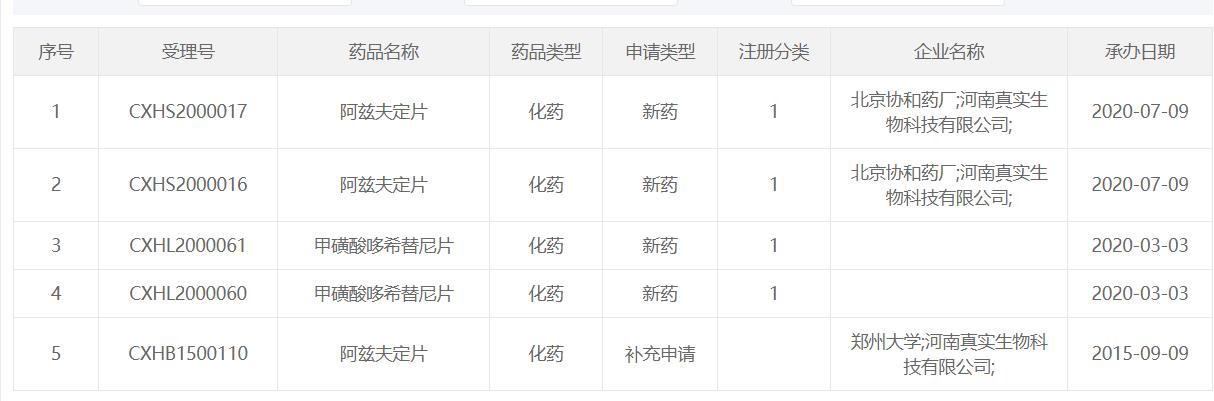
界面新闻查阅国家药品监督管理局药品审评中心官网发现,阿兹夫定片早在2015年就曾由郑州大学及真实生物补充申请受理评审。直到2020年7月9日,北京协和药厂和真实生物再次以“新药”对阿兹夫定片进行申请。
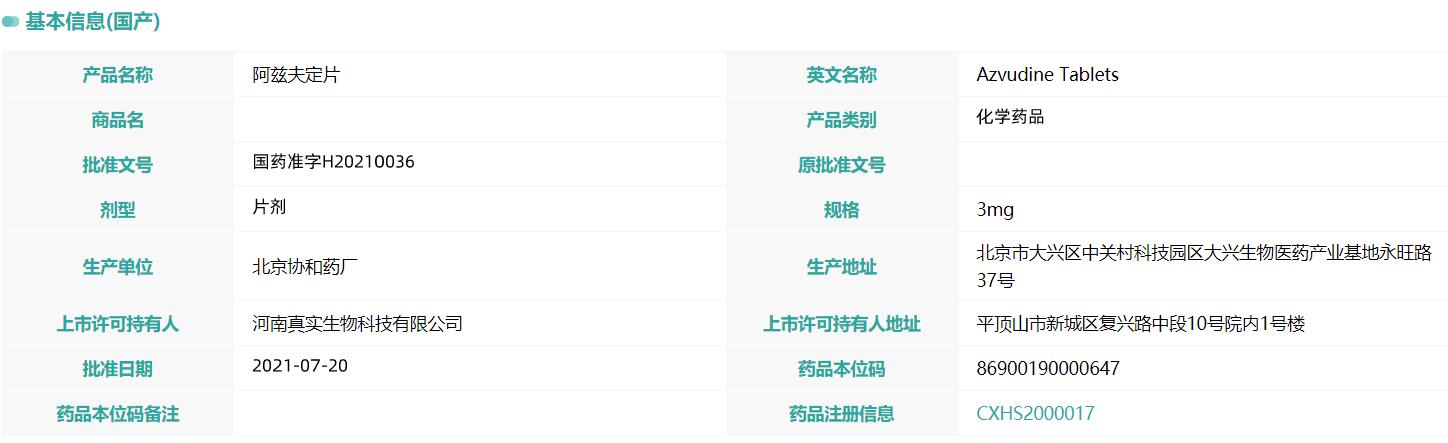
“戊戌数据”资料显示,阿兹夫定片的生产单位为北京协和药厂,批准文号为“国药准字H20210036”,批准日期为2021年7月20日,中标价格为2098.60元每瓶。
“真实生物”很神秘
那么,真实生物何许人也?
天眼查APP显示,真实生物成立于2012年,是一家集研发和生产为一体的具有自主知识产权的生物医药企业,主要致力于抗病毒和抗肿瘤药物、心脑血管以及肝脏疾病等治疗药物的研发。
真实生物的注册地位于河南省平顶山市,注册资本8亿元,但实缴资本仅1000万元,参保人数也仅有48人。该公司最终受益人为“王琳”,由一家名为“Genuine Biotech HK Limited”的香港企业100%控股,这也给这家医药公司蒙上了一层神秘色彩。

在真实生物官方微信公众号为数不多的文章中,界面新闻注意到,在2021年9月的一篇文章中提到,“早在2020年新冠疫情爆发之初,阿兹夫定就开展了治疗COVID-19的相关探索,在初步临床试验中,10位患者4天内第一次核酸转阴率达到90%”。
真实生物CEO杜锦发表示,阿兹夫定目前正在中国、巴西、俄罗斯开展三期临床,估计很快会有不错的结果出来。“如果效果理想,我觉得核苷类药物口服、低成本的优势,将对之后的疫情防控提供帮助。”
今年2月23日,河南省省委书记楼阳生一行曾到真实生物调研指导, 他表示十分关注真实生物自主研发口服小分子新冠治疗药的临床进展,希望药品能早日完成报批,造福全球患者。
真实生物再次提到,“公司自主研发口服小分子新冠治疗药因其卓越的抗病毒疗效成为国内口服抗新冠药物研发第一梯队”,“阿兹夫定治疗新冠肺炎的三期临床试验正在中国、巴西和俄罗斯全力推进”。
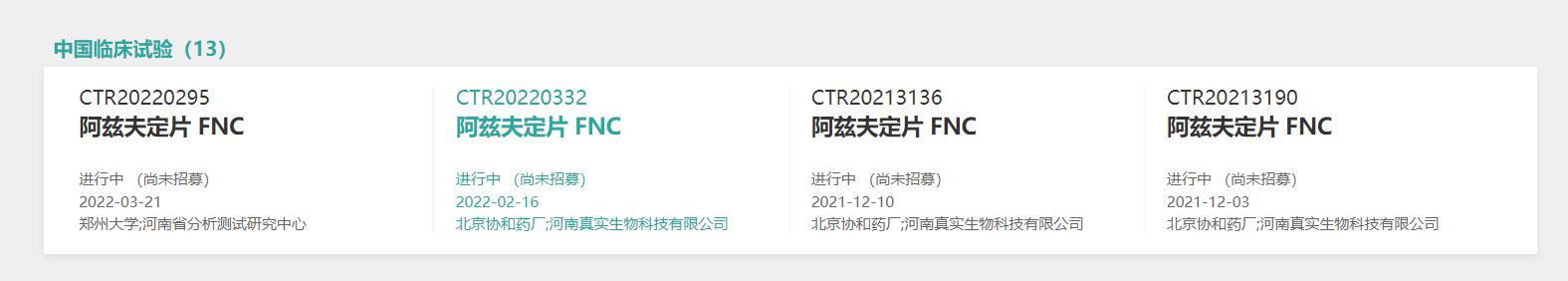
不过,在关于阿兹夫定片多个公示的国内临床实验中,界面新闻记者并未发现有关新冠治疗的相关实验目的,且上述临床试验均显示“尚未招募”。
此外,河南师范大学官网还发布“常俊标教授及其团队获科技部表彰”一文称,常俊标带领团队研发的我国拥有自主知识产权和全球专利的1.1类新药对新冠肺炎患者展示出良好治疗效果,受到国务院联防联控机制重点关注。而这里提到的1.1类创新药,正是阿兹夫定。
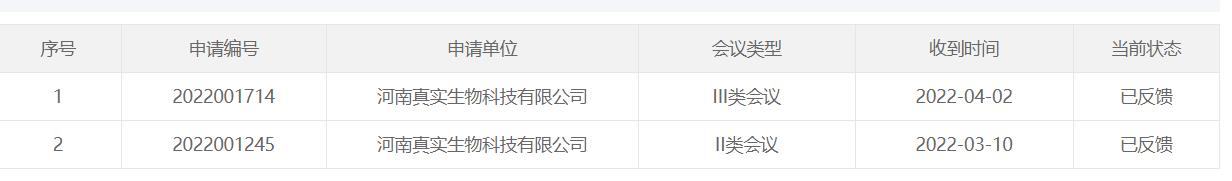
国家药品监督管理局药品审评中心官网显示,真实生物4月2日提交的III类会议申请,目前状态为“已反馈”。市场将此解读为阿兹夫定三期临床揭盲、申报上市在即。
首款国产新冠口服药花落谁家?
尽管阿兹夫定尚未获批用于新冠病症,但随着真实生物治疗新冠肺炎“揭盲”越来越近,相关新冠口服药概念股已经闻风而动。
界面新闻注意到,早在3月24日起,华润双鹤股价便在5个交易日内上涨超过23%。截至4月19日收盘,华润双鹤累计涨幅超过92%。
彼时曾有人以投资者身份致电华润双鹤,其证券部人士表示,对这一传闻所述情况不知情,“关于公司与真实生物签订代理生产、销售协议的事情我没有听说过,建议以公司公告为准。”
此外,从华润双鹤近日公布的年报来看,界面新闻也并未发现任何有关新冠口服药物研发或阿兹夫定的表述。
而作为阿兹夫定原料药的生产企业,总部同样位于河南省的拓新药业或成为直接受益者。今年以来,该股累计涨幅已经超过160%,截至4月19日收盘,每股价格高达209.22元。
对此,拓新药业在回复深交所关注函时表示,公司子公司阿兹夫定原料药的产能、产量及销量均比较小,最近一年及一期实现的营业收入及占比也比较低,同时,公司目前无在手订单,阿兹夫定原料药的销售对公司财务状况和经营成果的影响较小。新产线根据计划正在建设中,尚未取得相关主管部门的审批,投产时间存在不确定性。
尽管阿兹夫定能否成为首款国产新冠口服药尚无定数,但值得一提的是,除真实生物外,多家上市公司相继披露各自新冠口服药的研发进展,其中君实生物的VV116、开拓药业的普鲁克胺研究进展相对处于领先位置,均已进入三期临床阶段。
4月17日晚,君实生物-U(688180.SH)公告称,公司控股子公司君拓生物与苏州旺山旺水生物医药公司合作开发的口服核苷类抗SARSCoV-2药物VV116片(简称“VV116”)作为潜在呼吸道合胞病毒(简称“RSV”)抑制剂的临床前体内药效研究成果于Nature旗下刊物在线发表。VV116是一款新型口服核苷类抗SARS-CoV-2药物,可抑制新冠病毒复制。
研究发现,VV116在RSV多个敏感细胞系上具有优异的抗病毒效果。在小鼠模型上,VV116具有显著优于利巴韦林的抗病毒效果,且能缓解肺部组织的病理损伤情况。目前VV116处于国际多中心三期临床研究阶段,多项针对轻中度和中重度新型冠状病毒肺炎患者的临床研究正在进行。
君实生物4月7日还曾在投资者互动平台上表示,VV116已在乌兹别克斯坦获得批准用于中重度COVID-19患者的治疗。
在此之前,开拓药业(09939.HK)、先声药业(02096.HK)、前沿生物(688221.SH)、歌礼制药(01672.HK)、科兴制药(688136.SH)等公司均相继披露了各自新冠口服药的研发进展。
其中,开拓药业公布了普克鲁胺治疗轻中症非住院新冠患者III期临床试验的关键数据结果。临床试验结果显示,普克鲁胺可有效降低新冠患者的住院/死亡率,特别是对于服药超过7天的全部患者,相应保护率达100%。而先声药业的新冠小分子口服药物SIM0417于今年3月进入临床I期。
科兴制药则在年报中表示,关于在研新冠口服药物SHEN26,目前临床前工作除了部分毒理数据报告还未完成,其余工作基本结束。计划在国内开展I期临床试验,及海外II、III期多中心临床试验,并推进EUA或附条件批准上市。
而在已上市的新冠口服药中,辉瑞的Paxlovid今年2月获得国家药监局附条件批准上市,目前已进入部分省市医保体系。
有业内人士认为,新冠口服药有望从研发阶段逐渐进入商业化阶段,这将推动上游中间体和原料药的需求增长。




评论