文|财健道 杨燕 张羽岐 吴妮
编辑|杨中旭
制图|张羽岐
来自FDA的一纸通知,成为中国创新药出海的“生死劫”。
5月2日,同一时间段里,和黄医药(NASDAQ:HCM)和君实生物(01877.HK)先后披露了FDA关于旗下产品在美上市的回复函。
两个“坏”消息。
君实上市申请中的一项质控流程被FDA要求进行变更。对外公告中,君实表示该流程较容易完成,预计今天夏天会重新提交上市申请,也就是说,PD-1特瑞普利单抗的出海“签证”可能会延后发放。
和黄的情况看起来则更不乐观。FDA以美国患者数据不够多,数据不足以支持为由驳回了索凡替尼的获批,要求和黄补做国际多中心临床试验。
目前看来,和黄被拒的理由和当初的信达生物(01801.HK)颇为相似,还是“数据”和“流程”上的问题。
有信达先例在前,和黄的结果还是让市场颇为意外。
相比当初的信达,和黄多做了一项桥接试验(多用于跨种族新药实验中,支持某产品从一种组份、 人群、 接种程序等改变为其他类型的, 针对其有效性、安全性及免疫原性的研究)。
公告中提到,早在新药上市申请前,和黄医药曾和FDA达成一致,索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤患者的两项取得积极结果的中国III期研究,连同索凡替尼美国桥接研究的现有数据,可构成支持在美国提交新药上市申请的依据。
和黄3月4日的业绩交流会上,其首席科技官苏慰国同样提到,对索凡替尼在美国的审批进程充满信心。
峰回路转,结果出人意料。
中国创新药出海屡屡遭受波折,百济神州和传奇生物之后,各家纷纷“搁浅”,这会是一个信号吗?
01、疫情和数据,成为出海“关卡”
回复函公开后,美东时间5月1日,和黄医药开盘一度暴跌超22%,截至收盘,报收12.23美元/股,跌幅达18.95%。
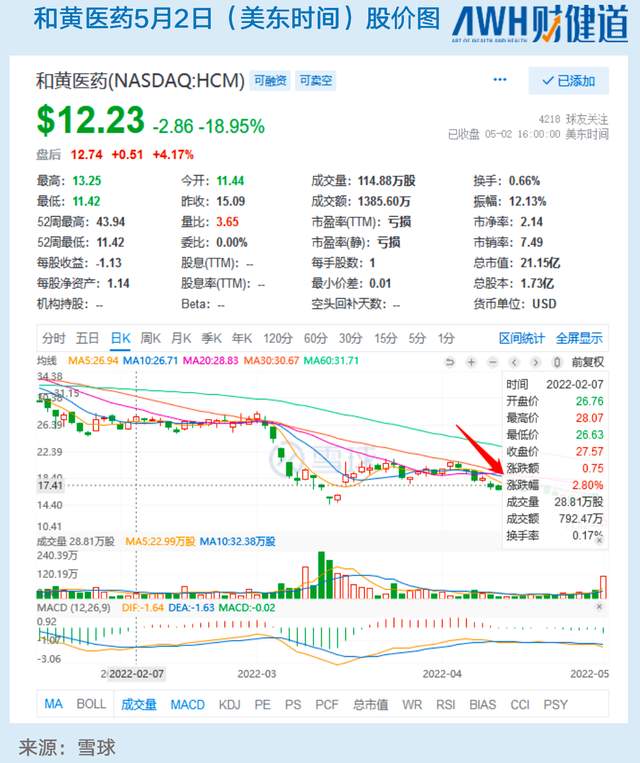
在FDA结果公布之前,就有业内人士对《财健道》表示,因为疫情原因,FDA估计无法前往苏州、上海等地进行现场核查,和黄和君实的出海申请“揭盲”的日子大概率会被延迟。
5月2日晚,和黄在消息公布后召开的电话会议中,也多次提到了疫情这一现实影响因素。尽管FDA去年年底已经完成了两次审查,但是剩余的两次审查由于地点的限制(苏州、上海)无法继续进行。
君实在公告中同样提到,特瑞普利单抗已顺利完成了FDA关于生产基地现场核查的在线部分,现场核查因新型冠状病毒肺炎疫情相关的旅行限制而受阻,具体时间将另行通知。
疫情这一客观因素之外,从中国创新药通向海外的“路”,显然还有很多待探索的盲区。
尽管和黄医药在申请之前就与FDA就数据问题进行了协调,但是目前来看,国际多中心实验仍然是FDA最关注的“规则”。
电话会议中,和黄医药表示对此问题背后的原因不做过多的探讨。对他们来说,FDA拒绝索凡替尼“出海”是一个无比悲伤的消息,但是数据的结果仍然表示索凡替尼对于罕见病胰腺和非胰腺神经内分泌瘤临床是有益处的,和黄医药与FDA的合作仍能继续。
作为和黄医药首个建立海外商业化团队的产品,索凡替尼可以说是“全村的希望”。
2019年11月,索凡替尼被FDA授予“孤儿药”资格用于胰腺神经内分泌肿瘤(“NET”)的治疗,而后于2020年4月被授予快速通道资格。如果孤儿药资质经FDA批准发售,索凡替尼对此适应症将得到历时7年的销售市场独占权。孤儿药资质还可在美国产生一定的项目成本盈利。
苏慰国此前介绍,和黄医药已经围绕索凡替尼建立美国商业化团队,为索凡替尼在2022年于美国的潜在获批做准备。在3月份的业绩会上,苏慰国透露该团队已有54个人到岗,计划大概在6月底会达到84人。
现在一切都成了未知数。
耗资不菲的桥接试验徒劳无功,补做国际多中心临床意味着上市日期至少半年以上的推迟。
对和黄来说,出海之路的第一步,路阻且长。
02、头对头,多中心,已经绕不开
和黄的经历会不会从个案变成普发性,市场对此不乏怀疑。
毕竟在和黄、君实之后,百济神州的替雷利珠单抗、康方生物的派安普利单抗等创新药也在冲刺FDA。
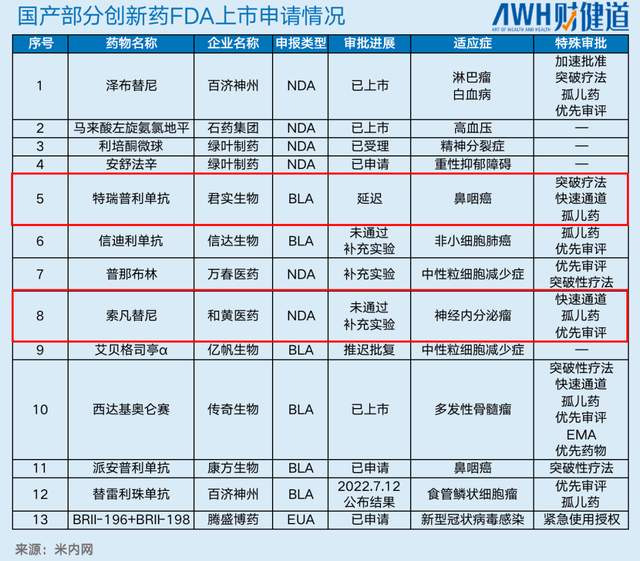
替雷利珠单抗的美国上市申请于2021年9月获FDA受理,用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性ESCC患者。FDA对此上市申请作出决议的目标日期为2022年7月12日。
百济神州会重复信达、和黄的故事吗?
从目前进展来看,百济神州在开展替雷利珠单抗对比化疗用于治疗二线食管鳞状细胞癌(ESCC)的全球III期临床试验(NCT03430843)之前已与包括FDA在内的药政监管部门进行充分的沟通。
临床试验中共有512例来自亚洲、欧洲和北美的11个国家或地区的患者入组试验。本临床对照组为化疗,即临床试验开始时的标准治疗之一。本临床试验主要终点为总生存率(OS)。这意味着至少在国际临床多中心这一点要求上,百济神州不会步信达与和黄的后尘。
但百济神州临床试验的对照组为化疗,缺少头对头试验,在美国对PD-1单抗审批收紧的背景下,仍存在隐患。
FDA的规则不断地变化,此前,FDA肿瘤学卓越中心(OCE)主任Pazdur的一讲话,就曾让国内资本市场就剧烈震动:“新药获批仅靠一个国家的临床数据,比如中国,显然是有问题的——这和美国在临床试验中努力增加患者多样性的原则背道而驰。”
除了美国市场,和黄当下在日本市场也在申请上市的过程中,而且同样是桥接实验,电话会议中透露已经处于审查的后期阶段,预期下半年可以完成。
全球化已经成为国内创新药企都无法忽略的战略成长方向,背后指向的,不只是广阔的市场空间,还有同台竞技的技术实力高低。
目前来看按照以往的方式走FDA的“旧路”似乎行不通了,新的成功路径又会是什么。
对还在队列中排队等待答案的创新药企来说,能从前面的失败案例中总结出“成功指南”吗?
(作者系《财经》研究员)



评论