文|化妆品观察
7月26日,广州市监局发布了《广州市市场监督管理局关于拟取消广州市未提交年度报告国产普通化妆品备案的通告》(下称《通告》)。

根据《化妆品注册备案管理办法》和《国家药监局关于实施〈化妆品注册备案资料管理规定〉有关事项的公告》(2021年第35号)等相关规定,拟取消截至2022年6月30日未通过国家药品监管局新注册备案平台提交备案时间满一年普通化妆品年度报告的广州市国产普通化妆品的备案。
而根据公示的《广州市未提交年度报告国产备案产品清单》,有近20万个产品将被取消备案。
01 未提交年度报告,近20万产品拟被取消备案
按照《国家药监局关于实施〈化妆品注册备案资料管理规定〉有关事项的公告》(2021年第35号),自2022年1月1日起,普通化妆品统一实施年度报告制度。备案人应当于每年1月1日至3月31日期间,通过新平台提交备案时间满一年的普通化妆品的年度报告。
另据《化妆品注册备案管理办法》,“普通化妆品的备案人应当每年向承担备案管理工作的药品监督管理部门报告生产、进口情况,以及符合法律法规、强制性国家标准、技术规范的情况。”
鉴于日期临近,受疫情等因素影响,仍有大量企业未提交旗下产品的年度报告,4月1日,广东药监局发布《关于普通化妆品备案年度报告工作有关事宜的通告》,将年报截止时间由3月31日延期至6月30日,并强调“逾期未按要求完成整改的,依法予以处置”。
据化妆品观察不完全统计,浙江省、江苏省、上海市、河南省、北京市、四川省、福建省、辽宁省、湖北省等省市,也都陆续发布通告,将普通化妆品备案年度报告截止日期延续到6月30日。
如今,3个月缓冲期已过,对于仍未提交的,根据《化妆品注册备案管理办法》第五十九条规定取消相关备案。
今日广州发布的《通告》中,同时以附件的形式公布了《广州市未提交年度报告国产备案产品清单》,该清单共计4639页,列有近20万个产品,包括广州市婵姿化妆品有限公司、广州汉芳生物技术有限公司、广州市艾雪化妆品厂有限公司等旗下产品。化妆品观察在国产普通化妆品备案信息平台查询广州汉芳生物技术有限公司发现,产品大多显示“异常!备案人未按法规要求进行年度报告”。
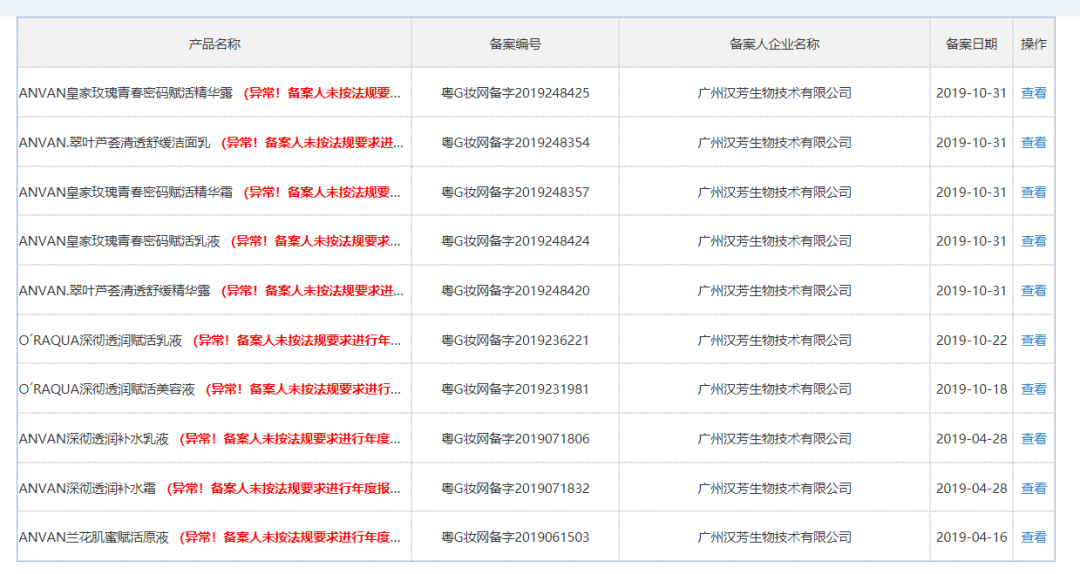
截自国家药监局国产普通化妆品备案信息平台
有行业人士表示,随着广州重拳出击清理,接下来,其它地区势必会有更多的“僵尸产品”被清理。
“被清理的核心原因在于,大多历史产品的委托方是品牌方,受质量安全负责人、质量管理体系、产品配方等因素限制,无法作为备案人在新平台注册账号。少部分产品是因为备案人工作疏漏或其他原因错过了年报提交导致。”上述人士表示,这无疑是对上述历史备案产品的一次“大清洗运动”。
02 被取消备案的产品,无法销售至保质期结束
据化妆品观察了解,预计到12月31日,历史产品还将面临第二次大清理。
早在今年4月27日,上海率先将化妆品企业产品分类编码、产品执行的标准、功效宣称摘要等资料补录的截止时间延期,从2022年5月1日延迟到了12月31日,随后,广东、江苏、北京、重庆、浙江等地纷纷延缓了期限。
对此,某企业负责人表示,对于因自身原因而无法完成功效宣称等资料补录的企业,即便延期,也难逃被淘汰的结局。
日前,福建省药品监督管理局发布公告,对149家化妆品企业的898个产品取消备案时,就有业内人士表示,“从最近的动作来看,产品认领和提交年度报告的时间一截止,多个监管部门就发布了取消备案产品名单,速度是相当快的。”他预测,待年底产品资料补录时间截止后,一大批未能补录资料的产品也将面临取消备案(详见《大清洗!1500+化妆品被取消备案》)。
需要得注意的是,根据《化妆品监督管理常见问题解答(四)》,对于无法提交相关资料的历史产品,企业主动注销和被监管部门取消备案有很大区别。
具体而言,企业申请主动注销的产品,如不存在违反法律法规的情形,可以销售至保质期结束。而监管部门取消备案则是对违法行为的惩罚措施,按照《化妆品监督管理条例》六十五条规定,备案部门取消备案的产品自取消备案之日起需下架、召回,仍然上市销售、进口该产品的,监管部门将按照规定依法予以处罚。
这意味着,企业当前只能选择加快进度提交年报、补录资料,或是主动注销,不然产品就得下架、召回,仍上市销售将面临严惩。
《通告》也指出,若产品备案人对被取消备案产品有异议的,可于8月8日至9日携带有效市场主体登记证明(《营业执照》等)复印件、《化妆品取消备案申辩书》前往广州市监局局提出陈述和申辩,逾期未提出的,视为放弃陈述和申辩的权利。而这无疑是给了企业一次排查隐患减少损失的机会。



评论