界面新闻记者 |
随着新冠疫情步入“乙类乙管”常态化防控,国产新冠口服药概念早已不再是市场追逐的热点,此前致力于新药临床试验的上市公司亦不再是投资者的“宠儿”。
3月23日下午,据国家药监局官方消息,近日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,附条件批准广东众生睿创生物科技有限公司(下称“众生睿创”)申报的1类创新药来瑞特韦片(商品名称:乐睿灵)上市。
随后众生药业发布公告证实了上述消息。众生药业表示,来瑞特韦片作为中国首款具有自主知识产权的3CL单药抗新冠病毒1类创新药物,其上市将有效提高公司的市场竞争力,增加公司的市场份额,进一步丰富了公司的产品线,对公司未来业绩将产生积极影响。公司来瑞特韦制剂及原料药同时获批上市,为后续的药品供应和质量安全提供了有效保障。
界面新闻注意到,众生睿创系A股上市公司众生药业(002317.SZ)的控股子公司,其研发的口服抗新冠病毒3CL蛋白酶抑制剂RAY1216片(即“乐睿灵”)早在2022年5月便获批进入临床试验。
根据众生药业此前发布的临床前研究显示,RAY1216对不同新冠病毒变异株(野生株、Alpha、Beta、Delta、Omicron)均有高效的体外抑制活性,抑制作用与被美国和我国药品监管部门批准紧急授权使用(EUA)或附条件批准上市的Paxlovid相当。

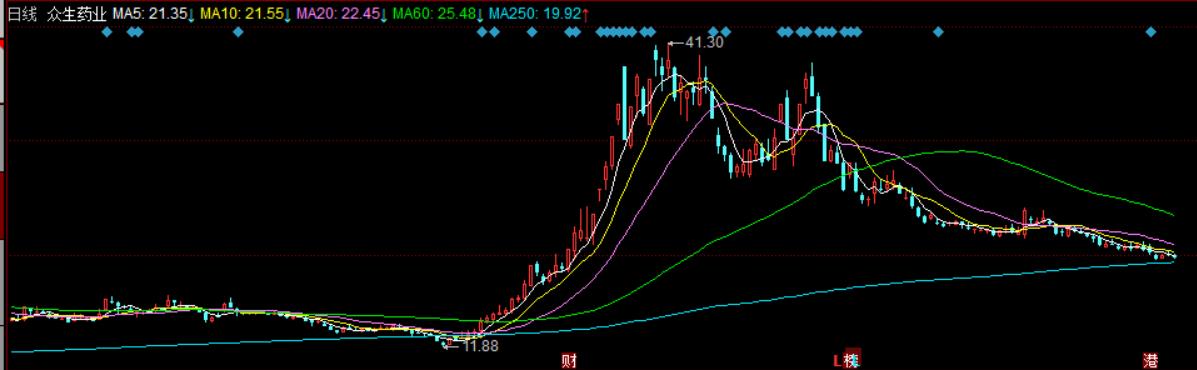
随着临床试验的不断推进,加之疫情的反复,众生药业去年下半年一度成为A股市场的“妖股”之一。从二级市场来看,其股价自去年9月底开始启动,在短短两个月的时间里累计涨幅接近2.5倍,最高时一度触及41.30元/股新高,总市值超过336亿元。
然而在经历了一轮爆炒之后,随着全国整体疫情进入低流行水平,众生药业便不再受到追捧,股价见顶后即一路震荡下调。截至3月23日收盘时报20.48元/股,距离前期创下的高点已经“腰斩”,市值蒸发接近170亿元。
直到今年3月15日,众生药业才宣布RAY1216的新药上市申请获得国家药监局受理,并称“临床研究已达到方案预设的主要疗效终点指标,不良事件发生率与安慰剂组相当,安全性良好”。然而这一迟来的“利好”显然没能让市场“买账”。
界面新闻注意到,作为红极一时的新冠口服药概念股,众生药业的表现并非孤例。
继去年河南真实生物的阿兹夫定率先获批上市后,进入2023年以来,君实生物(688180.SH)和先声药业(02096.HK)旗下的在研国产新冠口服药也在同一天获批上市。
1月29日,国家药监局官网消息称,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准海南先声药业有限公司申报的1类创新药先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)、君实生物旗下上海旺实生物医药科技有限公司申报的1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维)上市。
“靴子落地”之后,从二级市场来看,上述获批消息并未给两家公司的股价带来提振,相反却是一记重锤。其中,君实生物1月30日开盘后大跌5.33%,截至目前累计跌幅超过22%,而先声药业截至目前累计跌幅也接近17%。
业绩快报显示,2022年,君实生物实现营业收入14.53亿元,同比减少63.89%;实现归母净利润-23.98亿元,2021年同期为-7.21亿元;实现归母扣非净利润-24.60亿元,2021年同期为-8.84亿元。
据瑞信此前发布的研报显示,君实生物VV116销售预测显著提高,但港股评级由“跑赢大市”降至“中性”,认为现价水平已很大程度反映出VV116的商业潜力。瑞信预计,VV116未来可能会占据重要的市场份额,相信2023至2025年间对销售额贡献重大,但预期销售额将从2024年开始呈下降趋势。
有业内人士指出,随着疫情逐步得到有效控制,后续新冠口服药的市场需求也会有所回落,再加大投入的药企将面临较大风险。而随着越来越多的新冠口服药上市,布局该领域的企业可能会陷入“价格战”。
尽管投资者纷纷感叹其“生不逢时”,但仍有机构坚定看好新冠口服药市场。
华鑫证券研报认为,从美国感染趋势来看,随着新冠毒株的持续变异,在经历第一轮感染高峰后感染仍持续发生,新冠口服药需求度将持续存在。国内各地放开后,相继达到感染高峰,未来随着二次感染的发生,对于可缩短病程的新冠口服药需求将迎来高峰。此外,60岁以上人群对新冠特效药需求度将处于较高水平。




评论