文|氨基观察
11月28日,CAR-T公司度过了一个动荡不安的夜晚。
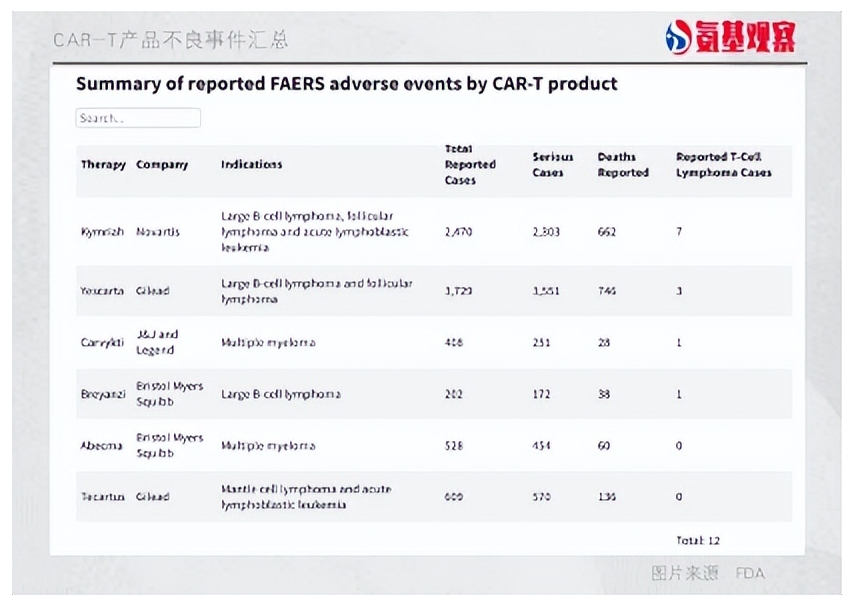
当天,FDA宣布,正在调查已上市的CAR-T疗法是否会在极少数情况下导致T细胞恶性肿瘤。根据FDA不良事件报告系统(FAERS)数据,目前共有12例相关案例。
调查消息一出,或许是担心FDA对于未来新产品的批准将收紧,二级市场反应最大的,不是已上市CAR-T产品的药企,而是在研相关产品的biotech,比如Cabaletta大跌27%……
这次调查接下来的走向,无疑值得市场关注。但不管结果如何,对于CAR-T疗法的未来,我们并不需要过于担忧。
毕竟,从面世之初,CAR-T疗法便饱受安全性困扰,但并不妨碍其市场规模水涨船高。

对于任何疾病而言,都讲究“风险收益比”。在临床中,CAR-T疗法已经被验证的,正是“收益大于风险”。这也是该疗法持续受到市场关注的核心原因。而从当前药企的临床研究来看,似乎也并非所有的CAR-T疗法都会引起这种“异常”反应。
所以,对于CAR-T赛道来说,关键的问题一直都是:谁能通过技术手段,持续为患者带来风险收益比更大的疗法。
01 报告12例T细胞恶性肿瘤
FDA的出击,来自于其掌握的最新证据。
根据FAERS数据,目前共有12例T细胞恶性肿瘤案例。也有外媒报道,FDA共收到19例报告。
FAERS是FDA开展监管工作的重要工具,例如发现已上市药品的新的安全问题、评价药品生产企业是否遵守报告规定及其对外界信息需求的反应情况。
当一款药品经FDA批准上市后,药品评价与研究中心和生物制品评价与研究中心的临床评估员,会对FAERS中该药品的报告进行评估以监测药品的安全性。一旦发现潜在的安全问题,则需进行进一步评估。
评估后,FDA将采取相应措施以提高药品的安全性,比如更新药品标识信息、限制药品使用、向公众公开最新药品安全信息、极少数情况下撤回药品。
也正因此,FDA调查消息一出,二级市场引起了剧烈反应。根据FDA所说,当前所有已上市的CAR-T疗法,都需要关注这一风险。
要知道,部分T细胞恶性肿瘤具备侵袭性强、病程短、预后不佳等特点,因此需要特别关注。
不过,对于FDA的表述,已有产品上市的药企均在当晚做出了紧急的发言或声明。
其中,BMS由于未有风险案例报告,其直接表示,在使用过Abecma治疗的4700名患者中,没有一例出现T细胞恶性肿瘤。
吉利德、诺华虽有案例报告,但均表示对自家产品充满信心,在目前接受治疗的患者中,未发现其与新发恶性肿瘤的发展有因果关系;
传奇生物则表示,即便没有CAR-T治疗,多发性骨髓瘤患者一样会有T细胞恶性肿瘤的风险;其他与骨髓瘤相关的治疗,如烷基化剂、免疫调节药物和自体干细胞移植,都有增加继发性肿瘤的风险。强生也是表示,到目前为止,Carvykti已被用于2000名患者,具有良好的获益风险特征。
02 有待持续关注的走势
作为细胞疗法的鼻祖,CAR-T疗法没少因为安全性问题翻车。Cellectis、Juno等巨头都出现过临床患者死亡的案例。
虽然目前已有多款CAR-T疗法上市,但该技术的安全问题并没有烟消云散。比如细胞因子释放综合征(CRS)、神经毒性等副作用都是CAR-T治疗中常见的副作用。
实际上,CAR-T疗法的潜在致癌风险,一直是FDA关注的重点。
与所有具有整合载体(慢病毒或逆转录病毒载体)的基因治疗产品一样,在美国处方信息中,对于已批准的CAR-T疗法,发生继发性恶性肿瘤的潜在风险均被标记为警告。
监管要求药企进行为期15年的长期随访观察性安全性研究,以评估长期安全性和治疗后发生继发性恶性肿瘤的风险。
但根据仅有几项临床研究长期随访后的数据报道,CAR-T治疗后二次肿瘤主要包括两大类:一是治疗相关髓系肿瘤,其中,治疗相关骨髓增生异常综合征发生率最高;二是其他实体肿瘤,发生率最高的为非黑色素瘤型皮肤癌。
正因此,业内对于此次T细胞恶性肿瘤的发现,颇为惊讶。
CAR-T技术的最初开发者之一、宾夕法尼亚大学教授Carl June表示,“这是第一批自体 T 细胞转化病例的早期报告。从科学上讲,了解这些病例是否预先存在可能导致这种不良事件的的克隆造血作用非常重要。之前接受过细胞毒性化疗的治疗可能会使患者更容易受到这种事件的影响。”
当然,CAR-T疗法是否会带来癌症风险,以及致癌的原因均尚不明确。至于结果如何,有待继续跟踪。
03 新药的风险收益比
总体来看,CAR-T疗法的未来依然是充满乐观的。
鉴于当前FDA披露的数据样本较小,一些华尔街分析师认为这种风险很低,还有人将之称为“茶杯中的风暴”。
支撑他们信心的核心在于,过去几年,CAR-T疗法在血液瘤领域,已经证实了自身能够为患者带来长期临床获益的巨大提升。
比如,与之前尝试一到三线治疗的多发性骨髓瘤患者的标准联合疗法相比,传奇生物的Carvykti在延缓肿瘤进展或死亡方面显示出74%的巨大益处。
而根据传奇生物在2022年美国ASCO年会上的报告,随访27.7个月后,Carvykti对于治疗复发或难治性多发性骨髓瘤患者具有深度和持久的缓解,ORR为98%;
再比如,当用作大B细胞淋巴瘤的二线治疗时,吉利德的Yescarta与标准治疗(包括化疗和干细胞移植)相比,将疾病进展、死亡或需要新疗法的风险降低了60.2%。
下图是Yescarta治疗难治性DLBCL的长期随访情况:OS率曲线在1年多之后仍保持稳定水平,2年OS率51%,3年47%,4年OS率仍然维持了44%的高水平。
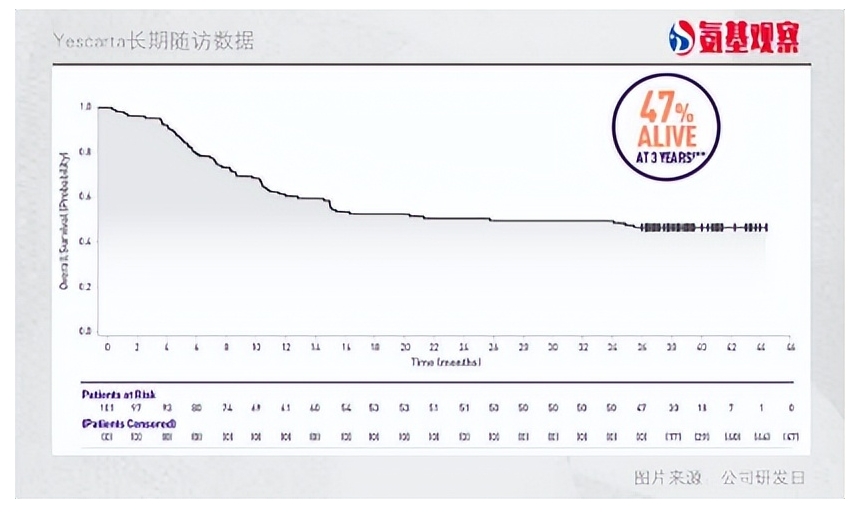
而在CAR-T出现之前,难治性DLBCL的OS率曲线基本都是持续下滑,即使是各种药物联用在2年后基本只有10%患者生存。从2年10%的生存率到4年超40%的生存率,背后的长期生存获益不可谓不突出。
虽然CAR-T疗法副作用很大、价格也较高,如今又有潜在致癌风险,但考虑到突出的长期生存获益,未来的发展仍拥有巨大的想象空间。
这其实就是新药的风险收益比。
正如Lareau教授所说的,新研究的发现会让我们更加谨慎对待CAR-T疗法,而不是单纯地否定它。
除此之外,在药企的努力下,CAR-T疗法的安全性也会逐步提升。以国内药企亘喜生物为例,据此前报道,其CAR-T疗法目前正展现出这种差异化安全性优势,在GC012F- r/r MM的研究中均未观察到第二原发性恶性肿瘤。
这也提醒所有CAR-T玩家,要想在这场竞赛中活到最后或是更进一步,唯有去做难而正确的事情。
任何时候,“迎难而上”都是与“创新”相伴同行的品质,我们不能要求药企在追求创新的同时,还能做到无风险、保守研发。
正好比,在众多CAR-T疗法的开发过程中,患者死亡的情况时有发生,也都被FDA叫停过临床试验。但最终还是有药企成功将产品推上市,为无数患者带去了生的希望。
鼓励创新,同时对创新风险收益比有所预期,有所准备。这样,便会有更多的人接受到鼓励,迎难而上。




评论