界面新闻记者 |
界面新闻编辑 | 谢欣
前路未明,追兵已至。这就是国内CAR-T细胞疗法领域商业化的现状。
CAR-T即嵌合抗原受体T细胞免疫疗法。其是将患者的T细胞经过基因工程手段体外修饰后回输至体内,使经过基因修饰的T细胞可以特异性地识别和结合肿瘤细胞表面抗原,并特异性杀伤肿瘤细胞,从而达到治疗的目的。
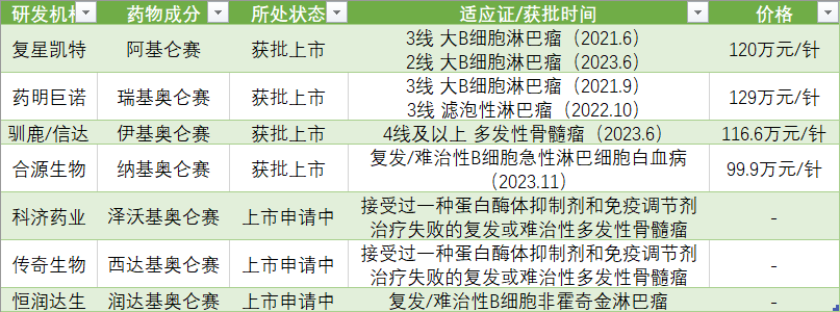
国内市场中,2021年首款CAR-T上市至今,已有4款产品获批,分别为复星凯特的阿基仑赛(商品名:奕凯达),药明巨诺的瑞基奥仑赛(商品名:倍诺达),驯鹿/信达的伊基奥仑赛(商品名:福可苏),以及合源生物的纳基奥仑赛(商品名:源瑞达),获批时间分别为2021年6月、9月、2023年6月、11月。
不过,目前CAR-T细胞疗法主要被批准用于二线及以后的肿瘤治疗,而且均为血液肿瘤,使得其适用的患者人群并不多,从相关企业披露的信息中也可以看出“这一困境。
截至2023年,奕凯达累计治疗超600位复发/难治性大B细胞淋巴瘤(r/r LBCL)患者。药明巨诺2022年年报则显示,上市以来,接受倍诺达治疗的患者有171位。2023年上半年,公司开出94张处方,完成85例回输。

除了适用范围外,高昂的治疗费用也是阻碍CAR-T细胞疗法推广的重要因素。
目前,国内CAR-T的定价依旧在百万级别。最新获批的源瑞达定价最低,也达到99.9万元/针,这还不包括产品以外的其他治疗费用。也因此,尽管治疗效果好,CAR-T产品短时间内难以进入国家医保。同时,这一疗法的患者可及性差,企业也难以变现回本。
此前,合源生物源瑞达定出99.9万元/针价格,首次把价格打到百万元以下,价格战将近之下,也有相关企业开始在支付端玩出更多花样。
复星凯特与宸汐健康日前就宣布,两者联合推出奕凯达按疗效价值支付计划。其中,宸汐健康为国药控股旗下健康管理和患者综合服务平台。
当下,奕凯达定价为120万元/针。该疗法的治疗过程可分为三步,分别为遵循医嘱下单、单采、回输。按照该计划,所有遵循医嘱使用奕凯达的患者将免费入组,完成单采后获得疗效保障权益。
其中,单采前和回输前分别需要缴纳60万元费用。回输后90±10天(即三个月),以PET-CT检查结果判断患者是否达到完全缓解(CR)这一判断疗效的标准。若未达到,患者将获得个人自费购药金额50%的报销金,其最高标准为60万元。
另外,该计划可以与惠民保等其他支付方式结合使用。国药控股创新中心副总经理王正珏以上海沪惠保举例,沪惠保在回输前可以提供50万元理赔。
换而言之,患者自费部分为70万元。若三个月后患者未获得CR,则将获得该计划35万元(70万元*50%)的报销金。
实际上,“按疗效支付”是药企和支付方共同分摊了患者用药结果的不确定性,以此来降低患者和支付方的顾虑,从而使用产品。此前,该模式在国内已有探索。其最大的难点是要有充足的真实世界数据和精算技术,来设计保障产品。
在这点上,复星凯特该项目负责人齐渊元告诉界面新闻,首先,CAR-T属于定制化产品,这意味着临床专家可以清楚地看到每个患者的疗效进展,这为按疗效付费提供了较好的数据支撑。
此外,相较于一些疾病治疗过程靠量表或一些血项做判断,不够客观,淋巴瘤有PET-CT影像学结果这一非常客观的评判标准。齐渊元介绍,该项目中的CR标准严格参照《2014版Lugano评估标准》,后者是全球权威、国内外专家都认可的标准。
另外,该项目选择3个月时的CR有两方面的考虑。齐渊元表示,一来,3个月的CR疗效与患者后面的OS(总生存期)、PFS(无进展生存期)有很强的相关性。二来,这样可以更早预测未来疗效,为医生和患者做下一步的治疗决策缩短时间、提供经济支撑。
不过,考虑到该模式先付后赔,依然需要患者先支付大几十万到120万的费用,对患者来说依然会是很大的负担。
另外,王正珏也向界面新闻表示,该项目的疗效性赔付金额非常高,这意味着过程中可能产生很多潜在沟通,可能会有来自患者自我认知、以及学术上的一些争议。项目运营过程中会多与患者、临床专家沟通。该项目赔付机制也不限于一道审核流程,也会借助公司保险端、临床端的资源。目前,该项目今年1月1日入组第一名患者,后续的沟通问题会在今年上半年晚些时间发现。
以此来看,本次试水的“按疗效支付”能在多大程度上解决CAR-T支付难题还有待观察。
实际上,尽管CAR-T尚属于新疗法,但国内这一赛道已有拥挤之势。除了前述4款已上市的产品,科济药业的泽沃基奥仑赛、传奇生物的西达基奥仑赛、恒润达生的润达基奥仑赛均处于上市申请阶段。而目前所有产品都集中在血液瘤领域。随着后来者逼近,其将在相同适应证上直接竞争。
因而,在血液瘤上向前线治疗拓展、开发实体瘤和自免适应证成为各家的选择。另一条路则是优化生产工艺,降低成本,开发通用型CAR-T等。
但相较于这些落地尚需时日的“出路”,CAR-T本身也面临新的竞争者。2023年11月,罗氏的格罗菲妥单抗(Glofitamab,商品名:高罗华)在国内获批,成为国内首款CD20×CD3双抗,用于3线治疗弥漫性大B细胞淋巴瘤、纵隔大B细胞淋巴瘤。




评论