记者 |
编辑 | 任悠悠
根据国家药监局药品审评中心(CDE)网站公开信息,“硫酸Larotrectinib胶囊”以及 “硫酸Larotrectinib口服溶液”的新药临床试验申请由拜耳公司申报,显示为2019年1月14日获“药审中心承办”。
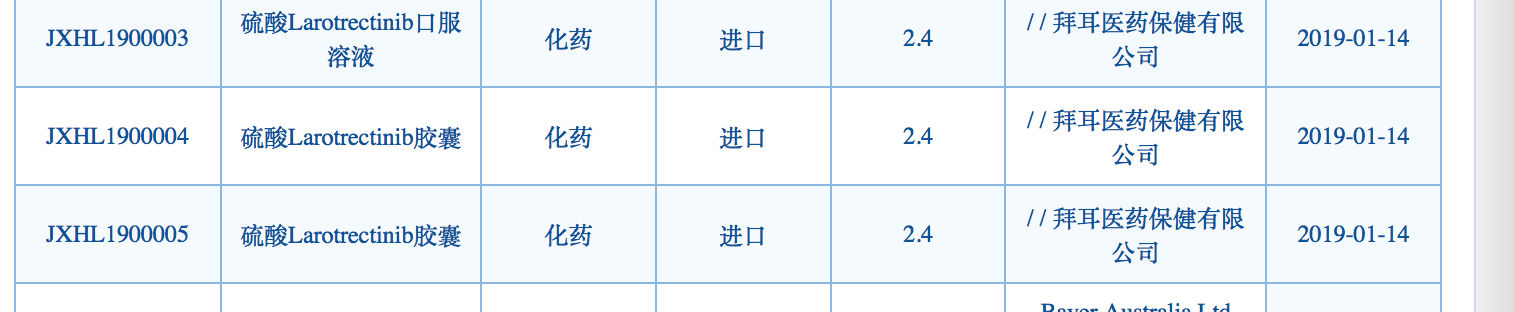
虽然还要经过临床试验和新药申请等环节,但考虑到国家对抗癌药加快审批的利好因素,这款抗癌药距离中国上市又近了一步。
此时距离Larotrectinib获得美国FDA批准还不到两个月。
一度刷屏
去年2月,世界四大权威医学杂志之一《新英格兰医学杂志(NEJM)》发表了一项关于抗癌药Larotrectinib的3项安全性和有效性临床的研究,结果显示“对于年龄为4个月至76岁的患者,针对17种不同癌症治疗的总体有效率为75%——其中,22%的患者达到完全缓解,53%为部分缓解。”

消息一出,立即引发广泛的关注。在支持美国获批的临床试验中,Larotrectinib在多种独特的肿瘤类型中显示了临床获益,包括肺癌、甲状腺癌、黑色素瘤、GIST、结肠癌、软组织肉瘤、涎腺肿瘤和婴儿纤维肉瘤。
去年12月Larotrectinib被FDA加速批准上市,用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,根据Larotrectinib一项临床试验的全球研究负责人David Hyman博士介绍,NTRK基因融合是一种罕见的癌症驱动因子,在常见肿瘤中 NTRK 突变率低于1%。
换而言之,Larotrectinib针对的肿瘤患者极其有限,不过,该药的确是美国FDA首个批准的“与肿瘤类型无关”的抗肿瘤化学药物。
FDA对Larotrectinib进行了优先审评,优先审评适用于那些可以显著提高治疗严重疾病的有效性或安全性的药物。FDA此前先后给予Larotrectinib突破疗法、罕见儿科疾病药品和孤儿药的资格认定。
权益归属
Loxo Oncology拥有一系列颇具潜力的的肿瘤药物。
2017年11月14日,Loxo Oncology曾与拜耳签订了协议,授予拜耳对Laotrectinib的共同开发和商业化许可。Loxo将领导Laotrectinib在美国的开发和申报,拜耳负责美国以外市场。
今年1月7日,礼来宣布将以每股235美元的现金(约合80亿美元)收购Loxo Oncology的所有流通股,包括其在研管线中的一系列重磅药物——LOXO-292、LOXO-305、LOXO-195,也包括引起行业大范围讨论的“广谱抗癌药”Vitrakvi(Laotrectinib)。
礼来收购Loxo之后,Laotrectinib的权益归属问题也引起关注。
根据此前Loxo与拜耳的协议,Loxo已授予Bayer对Laotrectinib和LOXO-195的共同开发和商业化许可。自生效之日起,公司有资格获得拜耳不可退还的4亿美元现金支付。LOXO-195是另一款TRK抑制剂,该产品有望于2022年上市。
在拜耳负责商业化的美国以外地区,拜耳将向Loxo分阶支付款项,包括两位数的净销售额和销售里程碑付款,总额为4.75亿美元。
也即是说,在不改变原协议的情况下,Loxo与拜耳的合作还将继续。如果礼来要签订新的协议,或将支付巨额资金。
当然,对患者来说,Larotrectinib的权益归属并不是关注焦点,何时能够用上药,药品的价格能否接受才是患者最关注的问题。
据公开信息,在美国30天用量的Larotrectinib成人胶囊需3.28万美元,儿童口服液配方的费用起价为每月1.1万美元。




评论