记者|谢欣
在百时美施贵宝(BMS)宣布将对新基公司进行收购后,市场除了惊呼将出现一家“实体瘤+血液瘤”巨头外,也波及到了第三方百济神州。由于百济神州2017年把当家在研产品抗PD-1抗体替雷利珠单抗对众多全球市场权益许可给了新基,替雷利珠单抗的海外命运也突生变数。
6月17日答案初步揭晓,百济神州宣布与新基达成共识,终止双方关于百济神州在研抗PD-1抗体替雷利珠单抗的全球合作。新基同意就合作终止向百济神州支付1.5亿美元。整个决定并不出人意外,只不过可能比预计来的要稍微早了一些。
百济神州也的确表达了以上感受,在对界面新闻的回复中,百济神州表示此次授权收回比此前预期的时间稍早,本来原计划在今年第三季度百时美施贵宝对新基公司的收购完成后收回,其解释称这样“能够进一步布局和推进替雷利珠单抗的全球开发,而不是静等交易完成。早一步决策有助于让情形更加明朗,并使我们能够全盘掌握全球开发进展,从而最大化这款产品的价值”。
2017年百济神州与新基签署总额13.93亿美元的合作协议,新基获得替雷利珠单抗实体瘤适应症在美国、欧洲、日本以及亚洲以外多个国家和地区开发和商业化的独家授权;百济神州保留了在血液瘤领域的全球权利以及在除日本以外亚洲国家和地区的实体瘤权利。同时,百济神州收购了新基公司在中国的商业团队,并获得其在中国已获批商业化产品(ABRAXANE®、瑞复美®、维达莎®)的独家授权。
但在BMS收购新基后,已拥有Optivo的BMS自然不会在竞品百济神州替雷利珠单抗上进行投入甚至是商业化,百济神州自然也不会眼睁睁看着替雷利珠单抗的海外市场“突然死亡”,双方的“分手”在所难免。

实际上双方在两年前也做了预防措施,根据百济神州与新基的合作协议,替雷利珠单抗应当是新基拥有的唯一的抗PD-1抗体。而如今情形已经不符双方此前的协议约定。据悉,目前百济神州正负责与替雷利珠单抗相关的90%的III期或者有望实现注册的II期临床试验,以及所有的处于早期阶段的临床试验。百济神州后续会继续负责相关临床试验,新基则将从其所负责的试验中逐步退出。
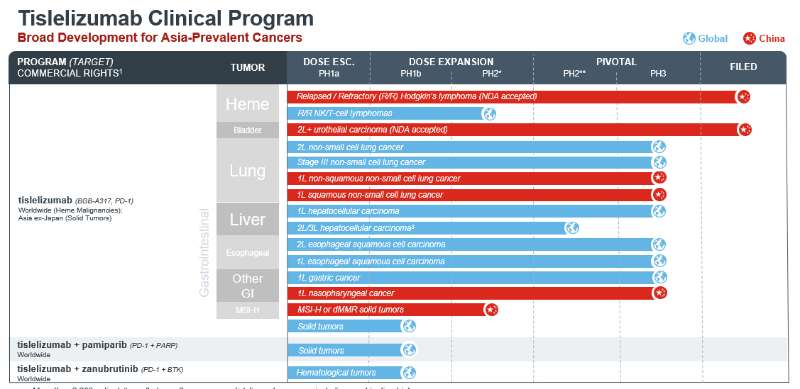
目前替雷利珠单抗在全球范围已经完成了一项针对复发/难治性(R/R)经典型霍奇金淋巴瘤(cHL)的关键性II期临床研究。其余正在开展的替雷利珠单抗的临床研究包括一项针对二线或三线非小细胞肺癌(NSCLC)患者的III期临床研究、一项针对一线肝细胞癌(HCC)患者的III期临床研究、一项针对二线食道鳞状细胞癌(ESCC)患者的III期临床研究、一项针对一线胃癌(GC)患者的III期临床研究、一项针对一线ESCC患者的III期临床研究、;一项针对二至三线HCC患者的II期临床研究、以及一项针对R/R NK/T细胞淋巴瘤患者的II期临床研究。
而替雷利珠单抗在中国正开展一项针对一线非鳞状NSCLC患者的III期临床研究、一项针对鳞状NSCLC患者的III期临床研究、一项针对鼻咽癌(NPC)患者的III期临床研究、一项针对一线尿路上皮癌(UC)患者的III期临床研究、一项针对局部晚期或转移性UC患者的关键性II期临床研究、以及一项针对具有高度微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)实体瘤患者的II期临床研究。
不过对于替雷利珠单抗相关海外权益的后续安排百济神州并未透露,仅表示公司现在拥有完全的自主选择权,可独立开发也可能寻求合作或者授权协议。据悉目前百济神州在美国已有自己的商业化团队,主要领导均已到岗。但不可否认的是,突然的变动给替雷利珠单抗海外市场增添了许多变数与挑战,面对复杂的全球市场,已在研发上投入巨资的百济神州是否还有人力物力与财力独自进军海外?寻找下一个合作伙伴可能会是更可能的选项。
此外百济神州再度表示,其与新基关于瑞复美®、Abraxane®和维达莎®在中国的商业化权益的合作不会到影响。百济神州依然拥有上述三款产品在中国的10年销售权。·




评论