记者 |
编辑 | 许悦
备受关注的国家医保谈判目录部分谈判于11月11日进入首日谈判。出人意料的是,虽然各参加谈判药企大都对谈判内容三缄其口并等待着国家医保局最终官宣,但却有一家本土药企杰华生物在当日宣布自己作为第一家谈判企业与国家医保局价格谈判成功。
杰华生物官网今天发布公告称,作为谈判药品的第一家,杰华生物与国家医保局价格谈判成功,现场获得医保局和杰华生物双方签字确认,“乐复能”将于2020年1月1日起正式进入国家医保报销目录,纳入医保基金支付范围,其支付标准和支付范围由全国各省市直接执行,各省市无权改动支付标准和支付范围。
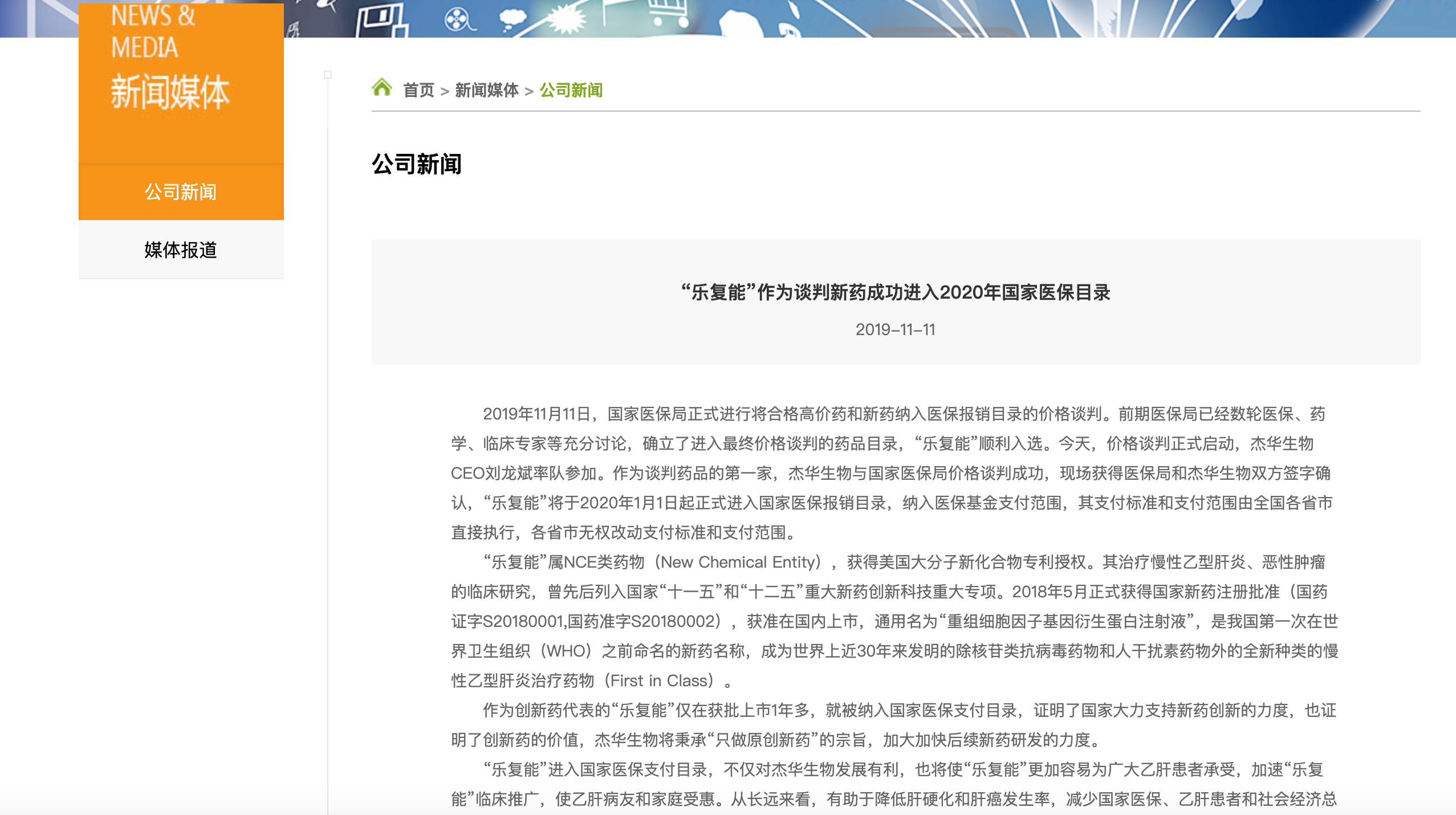
随后有自媒体报道称该公告已被删除,但界面新闻记者发现,实际上该公告仅是被隐藏,被未被删除。而国家医保局方面对杰华生物所发布的消息向界面新闻回应称“没有发布相关信息”。
杰华生物的乐复能并非无名之辈,虽然有肝病专家表示对其并不了解,但乐复能在医药产业圈中可能名声更大。早在乐复能获批上市之时,就曾遭到业界的各种质疑。
有效性究竟几何?

综合杰华生物公开资料,乐复能(Novaferon,通用名:重组细胞因子基因衍生蛋白注射液)是”杰华生物历经18年、投巨资研发的第一个蛋白质专利药物,适应症包括病毒性感染、恶性肿瘤和自身免疫性疾病等三大人类重大疾病”。2018年4月,乐复能治疗慢性乙型肝炎的新药注册申请正式完成,获国家药监局颁发的新药证书(国药证字S20180001)和药品注册批件(国药准字S20180002),获准上市。其他适应症处于临床试验或临床前研究阶段。
对于乐复能的质疑声主要集中在其临床有效性与安全性,以及上市合规性两大方面。
杰华生物称,重组细胞因子基因衍生蛋白注射液是中国第一次在世界卫生组织(WHO)之前命名的新药名称(通用名),成为世界上近30年来发明的除核苷类抗病毒药物和人干扰素药物外的全新种类的慢性乙型肝炎治疗药物(First in Class)。
然而,不仅国际上未有过“重组细胞因子基因衍生蛋白注射液”这一通用名,所谓免疫调节剂(干扰素)与核苷(酸)类似物外的“第三类乙肝药物”的说法也备受质疑。更多的声音认为,乐复能实际上是一款干扰素药物。
“我们基本上是这么认为的。”国内一位三甲医院肝病中心教授对界面新闻记者表示。
目前临床乙肝治疗药物主要为为核苷(酸)类似物和干扰素,前者主要有拉米夫定、阿德福韦酯、替比夫定、恩替卡韦和替诺福韦酯;后者包括普通干扰素和聚乙二醇化干扰素。干扰素治疗慢性乙型肝炎在相对确定的疗程内患者的病毒抑制率和HBeAg(乙肝e抗原)消失率或血清学转换率较高,停药后复发率较低,两种治疗方法具有互补性。综合价格、有效性与不良反应,目前临床上使用更多的是口服核苷(酸)类药物。
国家药品监督管理局药品审评中心(CDE)此前已公开乐复能的审评报告。报告显示,乐复能在上市申请时提交了一项I期慢性乙型肝炎患者的随机、开放性临床研究报告,以及一项随机、双盲、阳性对照HBeAg阳性的慢性乙型肝炎患者的III期临床研究报告。
I期研究数据显示,在药代动力学部分,在研究者设定的的多个疗效评价指标中,大部分指标无好转,仅有少数指标出现好转且不明显。而III期临床研究甚至未进行药代动力学研究,CDE认为,本研究的3个连续给药方案本身缺乏设计依据,本研究结果对后续临床试验给药方案的参考价值也很有限。
再来看有效性,这部分杰华生物提交的是上述这份III期临床研究报告,研究设计为HBeAg 阳性的慢性乙肝患者中的随机、双盲、阳性对照、多中心临床研究;双盲治疗12周后受试者在未揭盲的情况下进入随访期。随访期内受试者可自愿选择开放治疗12周,开放治疗结束后要进行至少12周的停药随访观察。
研究结果显示,前12周普通干扰素对照(试验组166例: 对照药167例)后,主要疗效指标试验组和对照组的血清HBeAg转阴率分别为27.11%(45/166)和16.17% (27/167),组间比较差异有统计学意义;HBV DNA血清转阴率分别16.47%(28/170)和12.21%(21/172),两组之间差异无统计学意义。而用药12周后的开放治疗12周、停药12周及停药52周的有效性数据被认为“评价意义不大”。
CDE认为,III期试验中并未完全体现出普通干扰素规范全疗程治疗的效果,因此对乐复能在12 周时间点的比较结果对评价乐复能及对照药全疗程疗效的价值和比较性结果提出了疑问。换句话说,作为一项乐复能与干扰素的对照临床试验,由于临床试验设计的原因,其结果价值存疑。CDE在审评报告中写到:““由于临床试验设计的缺陷,12周后的试验数据对于确证疗效没有意义,已经完成的临床试验结果不能最终确证本品的有效性、不能评价本品的长期安全性”。
安全性上审评报告中指出:两组不良反应种类及其发生率相似,不良反应严重程度均以轻、 中度为主,无SAE(严重不良反应)发生,表明研究药物临床应用安全性好,与普通干扰素相似。值得注意的是,转氨酶升高、胆红素升高在所有不良事件、重度不良事件、导致研究终止的不良事件中,试验组(乐复能组)的发生率都高于对照组(干扰素组)。而I期临床研究结果的临床药理学评价部分则指出:本品的安全耐受性较差。
前文所提及专家则对界面新闻表示,乙肝药物疗效一方面要看HBV DNA和e抗原(HBeAg)转化的水平,另一方面表面抗原清除和表面抗原血清转换也是应当评估的数据,但是乐复能并没有展示这两者的数据。而从临床应用上他则指出,目前乐复能给出的治疗方案是一天一次肌肉注射,这将很大的增加患者的依从性负担、经济负担与不耐受风险。他还透露,乐复能在学术推广时也被宣传可以一周三次注射,但他认为这种方式“缺乏临床试验支持”。
事实上,审评报告中也明确指出,目前认为慢性乙肝治疗后HBeAg血清转换比HBeAg单独转阴更具有疗效意义,HBeAg单独转阴缺乏临床价值。
而最终,CDE根据专家会议形成的评价共识认为,乐复能3个月疗程的数据对于慢性乙肝治疗有初步疗效,用药3个月的安全性与普通干扰素相似。但对照评价共识,乐复能试验的主要疗效指标、疗程、3个月疗程的停药随访时间均与共识不符,因此现有治疗还不能确证乐复能最终的有效性、不能评价其长期安全性。
最终CDE给出了有条件批准上市的决定,并要求后续继续开展相关临床试验以进一步提供数据。”需进行上市后临床研究,以进一步确证本品的有效性和安全性。研究中特别关注临床实际大规模使用时,本品抗体产生后对疗效和安全性是否产生影响。应在批准上市以后 5 年内进行总结报告并递交监管机构。如果更大规模临床试验结果不支持现有临床结论,可能导致撤销本品种批准文号。”
私自变更临床试验适应症
如果说有效性与安全性上的数据还可以通过上市后研究进一步论证的话,乐复能从临床到上市申报的整个路径则令人不解。
根据CDE公布的审评报告,获准取得了用于肿瘤适应症临床试验批件,而并未获准用于肝炎适应症临床试验批件。在这种情况下,杰华生物却开展了适应症为慢性乙型肝炎适应症的临床试验,并利用获得的乙型肝炎适应症的临床试验数据用于申报新药证书。
查询中国临床试验注册中心可知,2010年乐复能在中南大学湘雅医院和首都医科大学北京佑安医院有开展两个乙肝治疗的干预性研究。而杰华生物所宣称将前往欧美上市,界面新闻在ClinicalTrails.gov中并未有查询到其有登记的海外临床试验。
事实上,乐复能在上市申请受理时药品名称为“重组高效抗肿瘤抗病毒蛋白注射液”,但被监管部门分为“本品命名存在问题,尚未经国家药典委核定通用名称”,在杰华生物把通用名更改为“重组细胞因子基因衍生蛋白注射液”这一中国全球首创通用名后,CDE依然建议根据药典委建议对通用名开展后续研究。
审评报告中透露,就获得慢性乙型肝炎适应症临床试验批件的资料申请新药证书进行审评是否 符合法律、法规的问题,CDE曾先后四次行文原国家食药监总局药化司请示。2015年4月10日,CDE收到原国家食药监总局药化司《关于重组高效抗肿瘤抗病毒蛋白注射液相关问题的再次回复》(食药监药化管便函[2015]395号),“建议你中心继续完成技术审评工作,针对本品的安全有效性及质量可控性提出技术审评意见,做出审评结论和审批建议”。
除此外,在临床研究规范性上,CDE还指出乐复能虽然不存在真实性问题,但存在规范性问题,“存在问题涉及伦理审查、合并用药漏报、不良反应漏报,违背方案入组、药品超温、及部分记录缺少等方面。”
不过,杰华生物在宣传中不仅对上述信息未曾提及,在官方微信公众号宣传文章中还表示“乐复能的作用具有广谱性。从可治疗疾病谱来分析,乐复能可广泛用于病毒性疾病(肝炎、禽流感、艾滋病等)、肿瘤和自身免疫性疾病等的治疗。其中,病毒感染包括乙型肝炎病毒、丙型肝炎病毒、禽流感病毒等;在抗肿瘤治疗中,对于测试的十数种肿瘤细胞:如肝癌、肠癌、肺癌、乳腺癌、前列腺癌、胃癌、食道癌、黑色素瘤均呈现明显的抑制作用。”
在适应症范围上也公开宣称乐复能可“治疗病毒感染性疾病”(乙肝、丙肝、禽流感、艾滋病、尖锐湿疣)、“治疗恶性肿瘤以及用于肿瘤预防”、“治疗自身免疫性疾病”(类风湿性关节炎、多发性硬化症、系统性红斑狼疮等)。
不折不扣的“神药”,简直堪比“药王”修美乐。而实际上乐复能目前仅获批于治疗 HBeAg阳性的慢性乙型肝炎的适应症,其所宣传的多项功能不仅没有获批适应症,有的甚至连临床研究数据都没有。
而根据公开资料,2018年A轮融资后,杰华生物估值达到26亿美元,成为“中国首家原创生物新药独角兽企业”,还是“山东省首家独角兽企业”、“青岛市崂山区独角兽”。
界面新闻就此联系杰华生物方面,但其一位行政方面负责人并未通过微信好友申请,拨打公司总机也并未有人接听。




评论