记者 |
新型冠状病毒疫苗已正式进入人体试验阶段。
全球临床试验登记网站clinicaltrials.gov显示,美国生物科技公司Moderna的SARS-CoV-2新型冠状病毒疫苗mRNA-1273的1期临床试验已正式启动。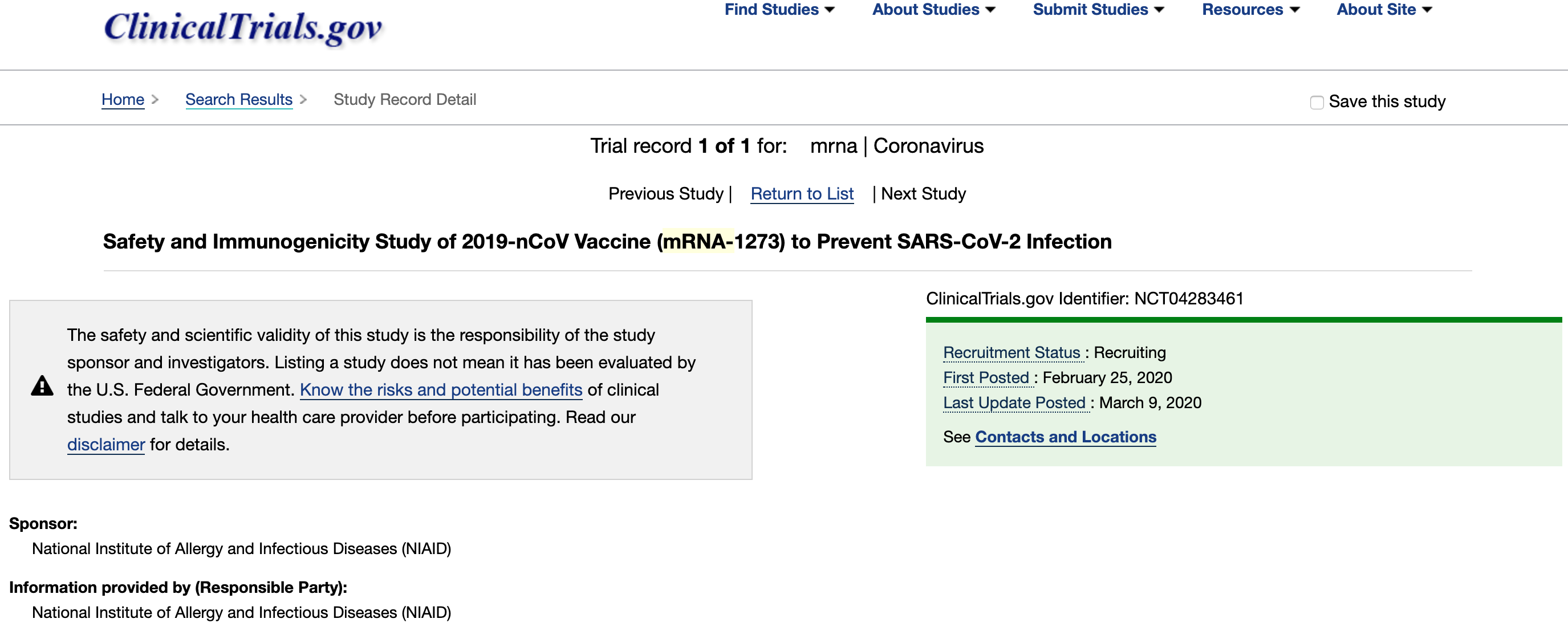
这项临床试验名为健康成年人对2019-nCoV疫苗(mRNA-1273)的安全性和免疫原性的I期开放标签和剂量范围研究(Phase I, Open-Label, Dose-Ranging Study of the Safety and Immunogenicity of 2019-nCoV Vaccine (mRNA-1273) in Healthy Adults),研究发起方为美国国立过敏与传染病研究所(NIAID),试验疫苗代号mRNA-1273,是由Moderna研制的mRNA疫苗,
所谓mRNA疫苗即messenger RNA(信使核糖核酸)疫苗,是一种较新形式的疫苗,与传统疫苗不同的是,它的研制不需要病毒或其蛋白质的实际样本,而是通过将编码病毒抗原的mRNA直接导入到人体,使之表达出特定的病毒蛋白,从而引发人体免疫反应,这种疫苗由于因为不含有病毒的蛋白成分,安全性很高。但由于本身容易被降解,稳定度往往不高。
mRNA-1273由Moderna研制,是目前全球范围内研发进度最快的新型冠状病毒候选疫苗之一。临床试验于今年3月3日正式启动,根据临床试验方案,计划招募45名年龄在15-55岁之间的男性与非怀孕的女性健康志愿者,目前已正式进入志愿者招募阶段。

这项临床试验将在美国国立过敏与传染病研究所进行,所招募的45名受试者将被分成3个队列,3组将会被注射三种剂量的mRNA-1273疫苗,分别为25mcg、100 mcg和250 mcg,每人将会在入组的第1天与第29天共被注射两次。研究方会对这些患者进行为期长达1年是随访,包括每次疫苗接种后第1、第2和第4周、以及第2次疫苗接种后第3、第6和第12个月。
试验将评估3组健康成人接种不同剂量的2剂mRNA-1273疫苗后的安全性和反应原性。该临床试验于2020年2月25日登记,根据美国食品药品监督管理局(FDA)对药品/疫苗临床试验所采取的30天默示许可制度,这项新冠病毒临床试验有望于3月下旬正式开始接种,甚至可能早于此前媒体报道的4月底开始。
不过,新冠病毒疫苗何时可以研制成功并正式用于人体依然是一个未知数,在此前美国总统特朗普在与美国制药公司高管们举行的会谈中,双方也为此争执不下,美国制药界坚持新冠病毒疫苗的研发至少需要一年时间。
而mRNA-1273的1期临床试验方案也给出了长达1年的随访时间,临床试验结束时间设置为2021年6月1日,不过有业内人士认为,这并不意味着这项试验真的一定需要等到那时才能结束。
一般来说,在1期临床试验结果良好的情况下,依然尚需开展2、3期的临床试验,不过在美国,特殊情况下FDA可通过紧急授权的形式(Emergency use authorizations,EUA)对特定医药产品进行批准使用。国内来看,全国人大常委会法工委、国家卫健委等部门也已多疫苗应急注册、应急使用有过表态,时间上存在大大加速可能。




评论