记者 |
莎普爱思于10月28日发公告称,公司核心产品苄达赖氨酸滴眼液(莎普爱思滴眼液)一致性评价工作可能无法在三年内完成,已通过浙江省药监局向国家局申请延期。
为什么三年都做不完?与今年许多业绩下滑的上市公司一样,新冠疫情显然是最好的“背锅侠”,毕竟属于不可抗力。
苄达赖氨酸滴眼液是莎普爱思的当家品种,多年来都是公司主要的收入来源,但在2017年年底医学界掀起了对其有效性的质疑浪潮,随后原国家食药监总局发文要求莎普爱思“按照《中华人民共和国药品管理法》及仿制药质量和疗效一致性评价的有关规定,尽快启动临床有效性试验,并于三年内将评价结果报国家食品药品监督管理总局药品审评中心”。
但直到2019年年报中,莎普爱思才披露了这项足以决定公司核心产品生死的研究进展,而中国临床试验注册中心网站上查询可知,这项临床试验直到今年4月10日才进行注册,想在三年期限内完成几乎是不可能的事情。
莎普爱思则称,这是因为“新冠疫情影响大,各研究单位有关工作暂停或进展缓慢,各医院伦理审查及合同审核时间较长,试验周期长,公司预计无法在原定期限内将评价结果上报国家药监局药品审评中心。公司已通过浙江省药品监督管理局向国家药监局申请延期完成一致性评价相关工作。”

除了申请延期外,莎普爱思同时提示,苄达赖氨酸滴眼液质量和疗效一致性评价工作存在无法按照国家药监局的要求在三年内完成的可能;或存在公司申请延期完成一致性评价相关工作未予通过的可能;或虽完成苄达赖氨酸滴眼液质量和疗效一致性评价并上报国家药监局药品审评中心,也存在未通过国家药监局的审评审批的风险。如出现上述情况,公司苄达赖氨酸滴眼液药品批准文号将可能被注销或到期后不予再注册,从而导致该产品不能继续生产销售。
看上去莎普爱思似乎言辞诚恳,然而仔细分析则不难发现,在这份公告之中,莎普爱思存在故意偷换概念,虚假陈述之嫌。
首先在于,所谓“苄达赖氨酸滴眼液的质量和疗效一致性评价工作”本身就是一个伪命题,原国家食药监局的要求是“按照《中华人民共和国药品管理法》及仿制药质量和疗效一致性评价的有关规定,尽快启动临床有效性试验”,一致性评价仅仅是一个标准规范性要求,最终的落脚点即临床试验的主要目的在于评价其有效性,而非其一致性。
因苄达赖氨酸滴眼液为意大利Angelini公司原研,莎普爱思为国内仿制,而一致性评价是将国内仿制药与原研药通过进行药学、生物等效性等方面的研究,评价其质量是否一致,但莎普爱思滴眼液显然与此不同。
医学界质疑的不仅是莎普爱思滴眼液这一个产品,实际上质疑的是通用名为苄达赖氨酸滴眼液的这一种产品的有效性,也就是说,即使莎普爱思能证明自己产品和Angelini公司产品质量疗效一样,这并不是当初质疑的答案所在。
而实际上,莎普爱思本身对这一点心知肚明,其在中国临床试验注册中心的注册临床试验名为“苄达赖氨酸滴眼液延缓早期老年性白内障有效性的随机、双盲、安慰剂平行对照、多中心上市后临床研究”,从名字(有效性)、试验方案(随机、双盲、安慰剂平行对照)上不难看出,这应该是一个评价有效性的临床试验,而并非评价其与原研药一致性的临床试验。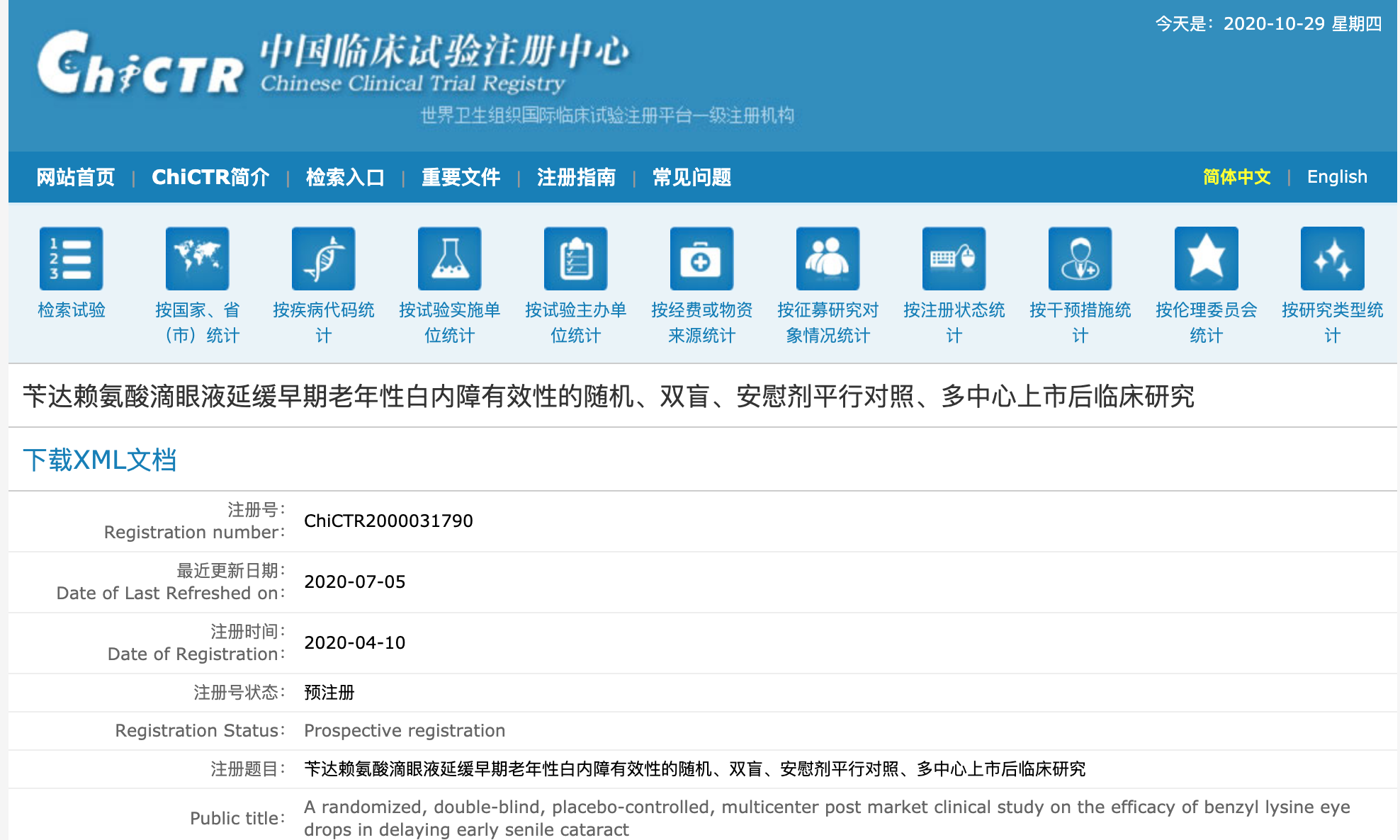
然而,莎普爱思在公告中却多次将此表述称“苄达赖氨酸滴眼液质量和疗效一致性评价工作”,存在故意误导投资者之嫌。
此外,再评价三年内无法完成,是否真的因为新冠肺炎疫情所致?答案可能要打上一个问号。
有资深从事药物临床开发人士对界面新闻记者表示,一般来说,一个药品从立项到提交临床试验申请(IND),快的话仅需一个月,慢的话需要开 pre-IND 会议,最起码约3个月,但如果是两年都无法拿到临床试验许可,就可以存在如立项后药物数据不好看,开发计划定不下来等问题。
此外,莎普爱思还归因于“各研究单位有关工作暂停或进展缓慢,各医院伦理审查及合同审核时间较长,试验周期长”等因素,但根据其临床试验方案,虽然名为多中心(及在多个研究机构同时开展),但其备案的研究实施地点却仅有中山大学眼科中心一家研究机构,何来“各医院”一说?而且这样的研究方案是否符合其多中心的要求?答案只有莎普爱思自己知道。
与此同时,虽然再评价工作拖了两年多才姗姗来迟,但期间公司原实控人却已套现离场,是否说明其对自家产品信心不足?而巧合的是,新晋实控人“莆田系”林氏家族旗下有着多家民营眼科医院。




评论