文|动脉网
医疗人工智能注册审批推进缓慢,相关制度的缺失是其关键原因。作为非传统类的软件类医疗器械,人工智能所使用的算法、调用的数据、作用的目标都在传统指导原则之外,审评审批人员不得不摸着石头过河,谨慎推进医疗人工智能的注册审批。
3月7日,国家药监局器审中心发布了一份长达41页的《人工智能医疗器械注册审查指导原则》(后简称《指导原则》),标志着上述现象成为过去式。本次指导原则事无巨细的描述了人工智能医疗器械的概念、注册基本原则、人工智能医疗器械生存周期过程、技术考量等部分,给予了注册企业明确的规定与标准。
为了理解《指导原则》背后的影响,洞悉医疗AI未来的发展方向,动脉网采访了相关专家,对政策内容进行全面梳理,尝试帮助医疗AI的从业人员理清药监局审批的思路与要点。本篇内容将从《指导原则》的增量信息、医疗人工智能企业的调整方向、医疗人工智能行业的整体发展三个方面切入,逐一解读政策全文。
5大关键解析增量信息
从屹立风口到稳步前行这七年,器审中心在医疗AI相关文件的发布上一向惜字如金。上一份全面的指导原则《深度学习辅助决策医疗器械软件审评要点》发布于两年前,新标准下,人工智能医疗器械有了通用指导标准,如今的审批审评要求也与过去有了极大的区别。

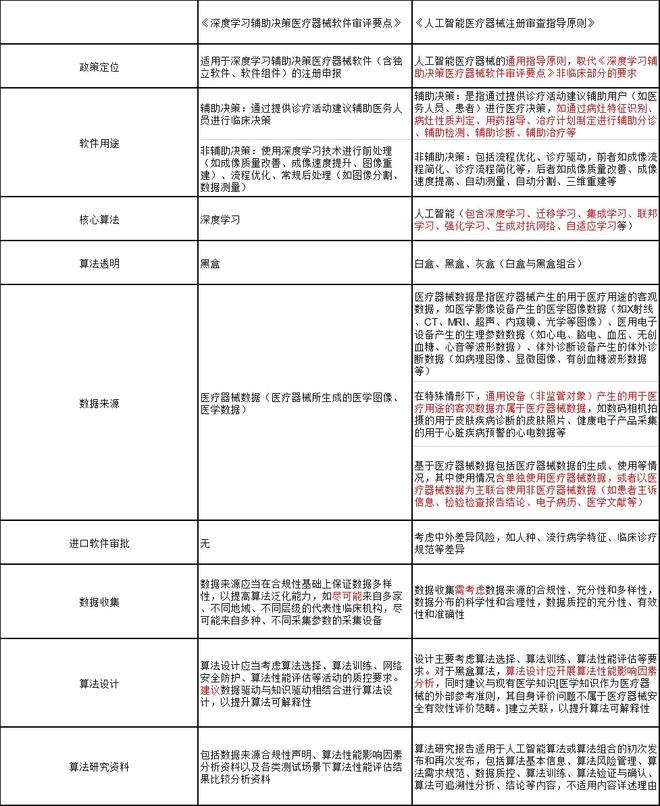
《人工智能医疗器械注册审查指导原则》与《深度学习辅助决策医疗器械软件审评要点》关键增量信息对比
关键信息对比上,前后两版政策在定位、软件用途、核心算法、算法透明等方面有了实质性的变化,而在数据收集、数据来源、算法设计上则进行了措辞的变更。
▶ 关键点一:医疗人工智能再定义
因此,上一轮人工智能政策被命名为《深度学习辅助决策医疗器械软件审评要点》,实则是对主流算法的规范与标准。从审批结果来看,器审中心通过的前12个医疗人工智能器械都在审批文件中标注了“深度学习”四个字。
然而,随着人工智能算法的不断发展,深睿医疗、联影智能、腾讯医疗等企业不断尝试小样本学习、无监督学习等新式人工智能算法,这些新的研究结果同样属于人工智能,但却未被审评审批包含其中。尤其是有监督学习下的人工智能,文件之中浓墨重彩地强调了它的积极意义。
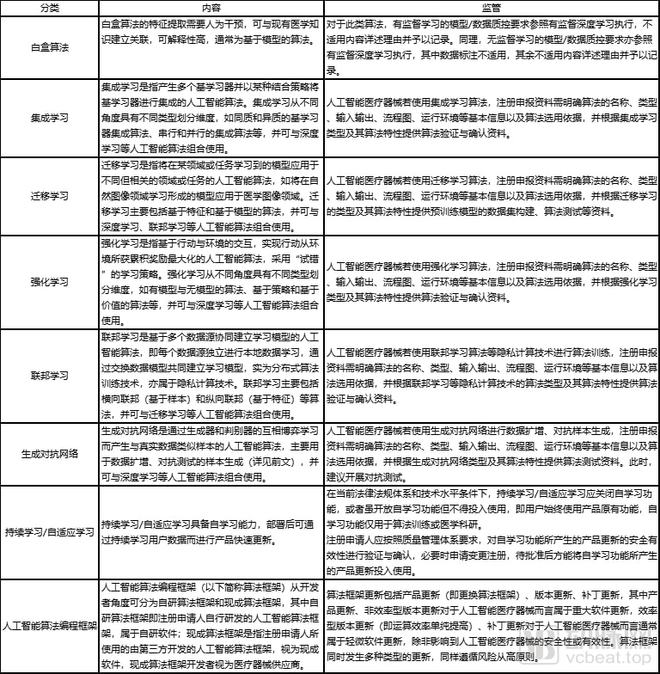
各类人工智能算法的内容与监管
医准智能联合创始人兼CTO丁佳表示:“人工智能医疗器械的审批本是在不断摸索着前行,若企业提出一些深度学习之外的创新算法,常常需要跟药监局来回沟通很多遍,才能确定注册时使用的产品功能与适用范围等信息。”
由此来看,《指导原则》发布的核心意义之一,是对人工智能的再定义。新政策下,各类创新人工智能算法有望加速通过该政策通过审评审批。
▶ 关键点二:算法的透明性
在《深度学习辅助决策医疗器械软件审评要点》中,“审评关注重点”一节的第一句就声明了“深度学习实为基于海量数据和高算力的黑盒算法”,因而后续的关注要点聚集于数据质量控制、算法泛化能力、临床使用风险等方向。
而在《指导原则》中,文件对人工智能所采用的算法作了“白盒”和“黑盒”的区分,要求白盒算法无论是有监督学习还是无监督学习,模型/数据质控要求均参照有监督深度学习执行,均需明确特征信息,如特征分类(如人口统计学、生物学、形态学)、特征属性(如形态、纹理、性质、尺寸、边界)、特征展现方式(如形状、尺寸、边界、颜色、数量)等信息。
在这一部分,动脉网曾提出“黑盒算法是否会在未来逐渐退出医疗人工智能辅助决策软件的使用要求”,对此医准智能联合创始人兼CTO丁佳表示:“尽管政策希望企业采用手动特征提取等方式加强算法的可解释性,但从目前行业来看,黑盒算法的准确率远超白盒算法,虽然不能解释,但可借助稳定性、鲁棒性等性能指标验证黑盒算法的可行性。”
▶ 关键点三:软件用途明确区分
通常情况下,我们习惯于视影像类AI为辅助诊断软件。在过去政策关于软件用途的定义之中,仅区分辅助决策与非辅助决策两类,具体的用词方式仅出现于三类证的发布之中。如今,《指导原则》对“辅助决策”四个字进行了精确的区分。
新标准下,人工智能医疗器械被划分为辅助分诊、辅助监测、辅助诊断、辅助治疗。回顾审评审批,鹰瞳科技、硅基智能、致远慧图的糖网病变、安德医智的颅内肿瘤磁共振等归类于辅助诊断;深睿医疗、推想科技的肺结节CT,汇医慧影的骨折x射线等归类于辅助检测;推想科技、联影智能、腾讯医疗的肺炎CT被分类为辅助分诊,由此可见软件的划分与AI的成熟度无关,与AI所解决的问题有关。
▶ 关键点四:数据来源
《深度学习辅助决策医疗器械软件审评要点》对于人工智能医疗器械的数据来源没有做详细的解析,只是提到是“医疗器械所生成的医学图像、医学数据”。
在《指导原则》中,医疗器械数据被明确定义为是指医疗器械产生的用于医疗用途的客观数据,如医学影像设备产生的医学图像数据(如X射线、CT、MRI、超声、内窥镜、光学等图像)、医用电子设备产生的生理参数数据(如心电、脑电、血压、无创血糖、心音等波形数据)、体外诊断设备产生的体外诊断数据(如病理图像、显微图像、有创血糖波形数据等)。
值得注意的是,在特殊情形下,通用设备(非监管对象)产生的用于医疗用途的客观数据亦属于医疗器械数据,如数码相机拍摄的用于皮肤疾病诊断的皮肤照片、健康电子产品采集的用于心脏疾病预警的心电数据等,这意味着,基于体素科技、丁香园等皮肤辅助决策小程序,患者用手机拍摄的皮肤照片同样可以被视为医疗数据,该项要求给予了皮肤类AI企业更多进步的空间。
此外,文中还提到“基于医疗器械数据包括医疗器械数据的生成、使用等情况,其中使用情况含单独使用医疗器械数据,或者以医疗器械数据为主联合使用非医疗器械数据(如患者主诉信息、检验检查报告结论、电子病历、医学文献等)”。换句话说,在未来的人工智能医疗器械审批中,文本类数据也有望成为重要的补充,甚至成为单独的人工智能工具。
2021年7月,森亿智能的VTE系统便获得了国家药品监督管理局给予的二类证,可以预见,未来将会有一大批企业会陆续跟进申请VTE系统的医疗器械注册证审批。
▶ 关键点五:数据收集与算法设计中的措辞变化
数据收集与算法设计两个关键环节决定了医疗人工智能的实际性能,无论是《深度学习辅助决策医疗器械软件审评要点》,还是《指导原则》都对这两部分进行了精细的描述。毕竟,在过去的审评审批之中,很多企业的算法准确性、敏感性、鲁棒性达不到监管机构的要求,其中的关键原因就是在这两个环节出了问题。
在《深度学习辅助决策医疗器械软件审评要点》中,器审中心没有明确要求数据来自不同的数据来源,只是让企业尽可能地保证数据的多样化,而在《指导原则》中,器审中心要求企业“需考虑数据来源的合规性、充分性和多样性,数据分布的科学性和合理性,数据质控的充分性、有效性和准确性”,希望从审批环节就推动企业提高人工智能医疗器械的鲁棒性。
算法设计同样存在类似转变。《深度学习辅助决策医疗器械软件审评要点》仅建议企业进行数据驱动与知识驱动相结合进行算法设计,以提升算法可解释性,《指导原则》则要求黑盒算法开展算法性能影响因素分析,提升算法可解释性。
对于企业而言, 官方指导像是一座灯塔,灯光引领之下,企业不再于黑暗中摸索,一切开始变得有条理。
“从短期来看,流程的规范化提出了一些新的要求,企业可能会在申请前做更多的多中心实验,进行多维度数据集的测试,这些流程可能会提升医疗人工智能企业在研发、注册方面的成本。”丁佳表示,“但将眼光放远,规范的体系必然在长期之中保有优势,保证医疗人工智能的质量,带动人工智能医疗器械CRO、数据集验证等产业链的发展,并使得研发企业的注册成本更为稳定。”
可以预见,在未来的一年中,我们有望看到更多元、更丰富的人工智能医疗器械在医院之中落地生根,而当产业发展走向稳定之后,质子重离子、脑科学等尚在发展之中的领域有望出现一波新的AI机遇。
从人工智能到数字医疗
指导原则之外,药监局还在3月7日、3月9日陆续发布了《国家药监局器审中心关于发布医疗器械网络安全注册审查指导原则(2022年修订版)的通告(2022年第7号)》、《家药监局器审中心关于发布医疗器械软件注册审查指导原则(2022年修订版)的通告(2022年第9号)》两大文件,其中的目的,是要建立完善全面的的数字医疗审评审批体系。
如今数字疗法、临床辅助决策等新兴概念飞速发展,不只是人工智能,数字医疗浪潮中涌现的各种事物都需要配套的审批进行规范,为产业的良性发展保驾护航。
对于人工智能而言,新政策的出现或许不会将其再度推上风尖浪口,但当众人逐渐形成对于AI共识,将数字医疗的介入视作一种常态,这个时候,徘徊数年的医疗人工智能企业或将加速驶入盈利时代。




评论