单个或多个基因突变导致了错误的蛋白质被编码,是很多疾病难以用传统药物治疗的原因。当人类生命“天书”——人类基因组序列被破解,从源头上调控基因表达从而治愈疾病已经成为人们迫切的期待。
寡核苷酸(oligonucleotide)药物的问世为许多疾病的治疗带来了希望。寡核苷酸分子能从基因入手,调控蛋白质表达,因此这类药物成功研发上市拓宽了疾病治疗的手段和边界。许多业界人士预测,寡核苷酸药物将成为继小分子药物和抗体药物之后第三波新药研发浪潮。
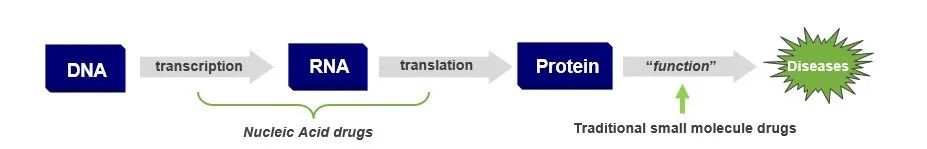
生命遗传密码在DNA-RNA-蛋白质之间的相互流转早已被揭示,而作用于基因调控的核酸类药物却姗姗来迟。由于寡核苷酸分子亲水性高,带负电性,不易透过细胞膜和血脑屏障,且易被核酸酶降解,如何在复杂的体内环境中将有效成分递送至“目的地”,一度成为寡核苷酸药物研发的瓶颈。
随着新型药物递送技术的发展,这个困扰产业多年的问题得到了突破。是什么技术突破推动了这波研发浪潮的来临?浪潮将至,如何才能让更多寡核苷酸新药惠及患者?
脂质纳米颗粒:突破寡核苷酸药物递送技术瓶颈
2018年,全球首款上市的小干扰核糖核酸(siRNA)药物通过新型脂质纳米颗粒(Lipid Nanoparticle, LNP)技术包裹递送到肝脏,用于治疗遗传性甲状腺素介导的淀粉样变性的多发性神经病。
LNP作为一种新型药物递送技术,翻开了寡核苷酸药物开发的新篇章。科学界对脂质纳米颗粒用于药物递送的探索由来已久,随着LNP技术的日臻成熟,功能设计日益完善,就像一个可以安全高效递送寡核苷酸分子的“运载火箭”。LNP通过脂质将寡核苷酸分子封装,帮助寡核苷酸分子跨越生物屏障,并在特定生理环境中释放,改善了寡核苷酸分子的递送和效价。
此外,LNP药物递送技术还有望帮助其他进入人体后较为“脆弱”易降解的创新结构分子发挥作用,已经成为众多创新药物和疫苗的“幕后功臣”,比如对目前两款mRNA疫苗的问世也功不可没。
LNP是如何突破递送瓶颈的?其存在哪些特殊优势?仍以寡核苷酸药物为例,这还要从其进入体内必须突破的三层生物屏障说起。

当寡核苷酸分子进入人体后,第一程是到达靶组织,在这个过程中,它需要躲避血浆和组织中核酸酶的降解以及免疫系统的捕获,才能顺利抵达首个目的地;第二程是要跨膜进入细胞内,因为寡核苷酸分子量较大,且表面带有负电荷,即使到达靶组织也无法自由通过细胞膜,需要借助“外力”才能进入;最后一关就是溶酶体逃逸,寡核苷酸分子需要在内吞体与溶酶体结合前逃逸,进入细胞质与目标基因结合实现基因调控。
LNP药物递送系统是由多种脂质分子组成的复杂结构,脂质分子所带的正电荷可与带负电的寡核苷酸分子相互作用,在适当的溶剂系统中快速混合后发生自组合,通过多重工艺参数控制,形成纳米级的脂质体颗粒,将寡核苷酸分子封装在内。不同的脂质组分在寡核苷酸的药物递送过程中发挥着不同的作用,是LNP制剂设计所考量的重要因素。
成功封装后,LNP就像给寡核苷酸分子加上了一层具有多重功能的“保护罩”,可以帮助寡核苷酸药物躲避免疫系统的捕获和核酸酶的降解,抵达靶组织。此后,LNP通过其不同功能脂质组分的助力,让寡核苷酸分子成功实现跨膜以及内吞体逃逸,最终通过基因调控达到治疗目的。
寡核苷酸药物、mRNA疫苗等创新产品的问世带动全球LNP递送系统的需求大涨,对于更好、更优质的LNP制剂工艺的期待推动着这一领域的快速进步。
多通道微混合:让LNP实现高品质规模化生产
LNP递送系统环环相扣的每个研发生产步骤对于最终的药物治疗效果都十分关键,脂质种类的选择、比例、浓度、生成温度、pH等工艺参数都要经过严格优化。即便如此,传统的LNP多种组分快速混合后自组合的机制依然存在着规模化的瓶颈,随着生产规模的放大,可能出现粒度分布、封装率以及重现率差等问题。
业界期盼高质、稳定、易放大的LNP制剂平台,以满足众多进入临床乃至商业化阶段的寡核苷酸候选药物工艺需求。药明康德子公司合全药业近日宣布,其无菌LNP制剂平台已正式投入使用。

合全药业LNP制剂平台的独特优势在于,其将多通道芯片、微混合系统以及复杂制备系统能力融为一体,形成多通道微混合核心技术,对粒度分布、载药率、包封率等关键参数的控制均有显著优势。
顾名思义,多通道微混合技术通过将不同LNP基础组分经由不同的通道,通过微混合器将各通道内含有寡核苷酸分子和各类脂质辅料的各溶剂相进行精细混合,进一步通过控制流量等生产操作参数,从而准确地生产目标粒径的LNP。
通过自组合形成的LNP实际上是分布在一定粒径范围内的混合物,其粒度分布范围越窄,意味着LNP相对均质性越高。值得一提的是,通过多通道微混合技术生产的LNP,具有优越的粒度分布,其聚合物分散性指数可以控制在小于0.1的狭窄范围内(PDI<0.10),这也是对LNP品质进行系统化评价的重要指标之一。
此外,多通道微混合技术有着业界领先的放大性和可重复性,稳定的工艺对于采用LNP作为递送策略的寡核苷酸药物的商业化而言意义重大。随着工艺优化和配方开发,合全药业无菌脂质纳米粒制剂平台可以为LNP提供各种组装结构,通过灵活的模块化平台技术,能实现不同生产规模的灵活切换,满足合作伙伴多样化的需求。
浪潮将至:如何满足寡核苷酸新药开发需求
随着递药系统等关键技术瓶颈的突破,越来越多创新药物企业开始涉足寡核苷酸药物领域。根据iCrowdNewswire发布的寡核苷酸市场分析报告,2019年全球寡核苷酸市场为43亿美元,预计到2024年全球寡核苷酸市场将达到82亿美元,预测期间的复合年均增长率为13.7%。
如何满足不断增长的寡核苷酸药物开发需求,是整个医药行业需要深入挖掘的方向。随着LNP制剂平台的启用,其将与合全药业的寡核苷酸CRDMO(合同研究、开发及生产组织)平台充分发挥CMC一体化协同效应,助力合作伙伴突破递送系统这一关键技术瓶颈,为其提供从原料药到制剂,从药物发现到商业化生产的一站式服务。
目前,合全药业已在全球设有12个研发和生产基地,分别位于亚太、北美及欧洲地区,均已通过全球主要监管机构的审计,拥有符合国际标准的质量体系,能为客户提供更为灵活的供应链保障。更重要的是,“一体化,端到端”的CRDMO模式具备独特的优势,不同业务模块能够高效联动、高度协同,将传统“线性”进行的研发环节,改为多条优化的“并行”的推进模式,既帮助创新者有效缩短开发的时间,也避免了项目转移引发的技术风险,充分发挥原料药与制剂一体化优势,为合作伙伴提供从药物发现到商业化生产的一站式服务。
“随着创新药物开发的持续升温,市场对于高端制剂的需求也快速增长。”药明康德联席首席执行官、合全药业首席执行官陈民章博士表示:“合全药业无菌脂质纳米粒制剂平台将满足客户在研发和生产方面的高质量需求,同时,我们也会进一步提升CRDMO平台的能力和规模,更好地赋能合作伙伴的创新药物开发,造福广大病患。”
所有过往,皆是序章。LNP药物递送技术也许只是一个新的开端和起点。我们期待,在全球医药健康产业同仁的通力合作下,未来能够有更多、更好的纳米药物递送技术问世,助力更多新分子破茧成蝶,成为拯救生命的治疗方案。

评论