记者 |
2023年首个交易日前夕,多款国产在研新冠口服药密集发布临床试验进展。
1月2日晚间,君实生物-U(688180.SH)发布公告称,公司控股子公司君拓生物与旺山旺水合作开发的VV116片完成一项对比Paxlovid用于伴有进展为重度包括死亡高风险因素的轻至中度新冠病毒感染患者早期治疗的III期临床研究,同时还在不同的人群中开展了多项VV116的国际多中心III期临床研究。
据最终分析结果,VV116组和PAXLOVID组在“至持续症状消失的时间”“至首次 SARS-CoV-2 核酸阴性时间”方面表现类似,中位时间均为7天。在每一个预设时间点(第5、7、10、14、28 天),VV116组症状缓解的患者比例均高于Paxlovid组。两组患者均未发生进展为重度/危重COVID-19或死亡。
值得一提的是,在安全性方面,君实生物强调,VV116比 Paxlovid的安全性顾虑更少。披露称,VV116组的不良事件发生率低于Paxlovid组。此外,Paxlovid与多种药物存在相互作用,而VV116不会抑制或诱导主要药物代谢酶,或抑制主要药物转运蛋白,因此与合并用药发生相互作用可能性小。
据悉,上述研究成果已在全球权威期刊《新英格兰医学杂志》在线发表,这是该期刊发表的首个中国自主研发的新冠创新药临床试验。另据君实生物一位高管日前接受21世纪经济报道采访时表示,VV116是唯一与Paxlovid“头对头”进行III期临床研究的国产新冠小分子口服药物。“从数据来看,我们的VV116有效性不弱于辉瑞的Paxlovid,安全性还更好一些”。

同一天晚间,科兴制药(688136.SH)发布公告称,公司全资子公司深圳科兴药业有限公司的新冠小分子口服药SHEN26胶囊II期临床研究已完成全部受试者入组。现阶段公司正进行“SHEN26胶囊治疗轻型和普通型新型冠状病毒感染患者的随机、双盲、安慰剂对照II期临床研究”。
据悉,在已完成的I期临床试验中,SHEN26胶囊显示出良好的耐受性和安全性。同时,近期完成的评估SHEN26胶囊对轻型和普通型新型冠状病毒感染患者安全性、有效性的IIT研究(“由研究者发起的临床研究” ),取得了积极结果。研究结果显示,SHEN26胶囊可以缩短轻症、普通型新型冠状病毒感染患者的核酸转阴时间,且安全性良好。
此外,众生药业(002317.SZ)也发布公告称,公司控股子公司广东众生睿创生物科技有限公司组织开展的RAY1216片,其用于治疗轻型和普通型轻型和普通型新冠病毒感染患者的随机、双盲、安慰剂对照III期临床研究,已按临床方案要求,完成全部病例数入组。
公告显示,III期临床研究于2022年11月获得组长单位广州医科大学附属第一医院伦理委员会审评批准,并于当月入组首例患者。入选人群包括伴或不伴高危因素的轻型和普通型新冠病毒感染患者,给药方案为RAY1216片400mg单药,连续口服5天,研究主要疗效终点指标为新冠感染患者临床症状/体征均持续恢复正常的时间。
据了解,III期临床研究已在广东、北京、山东、河南、江苏、湖北、内蒙古、江西、海南等全国多个省市区的33家临床研究中心开展竞争性入组,修订后方案计划入组1344例新冠感染患者,实际完成入组1360例。
界面新闻注意到,上述三家披露新冠口服药临床进展的上市公司均表示,相关临床研究进程、研究结果及审批结果均具有一定的不确定性。科兴制药、众生药业表示,临床试验进展对近期的财务状况、经营业绩不构成重大影响。
从过去一年的二级市场来看,新冠特效药相关概念股经历了一波大起大落,往往个股是在首次宣布涉足新冠特效药研发以及相关临床试验取得进展时迎来一波大涨,而在消息公布之后却经常陷入沉寂。
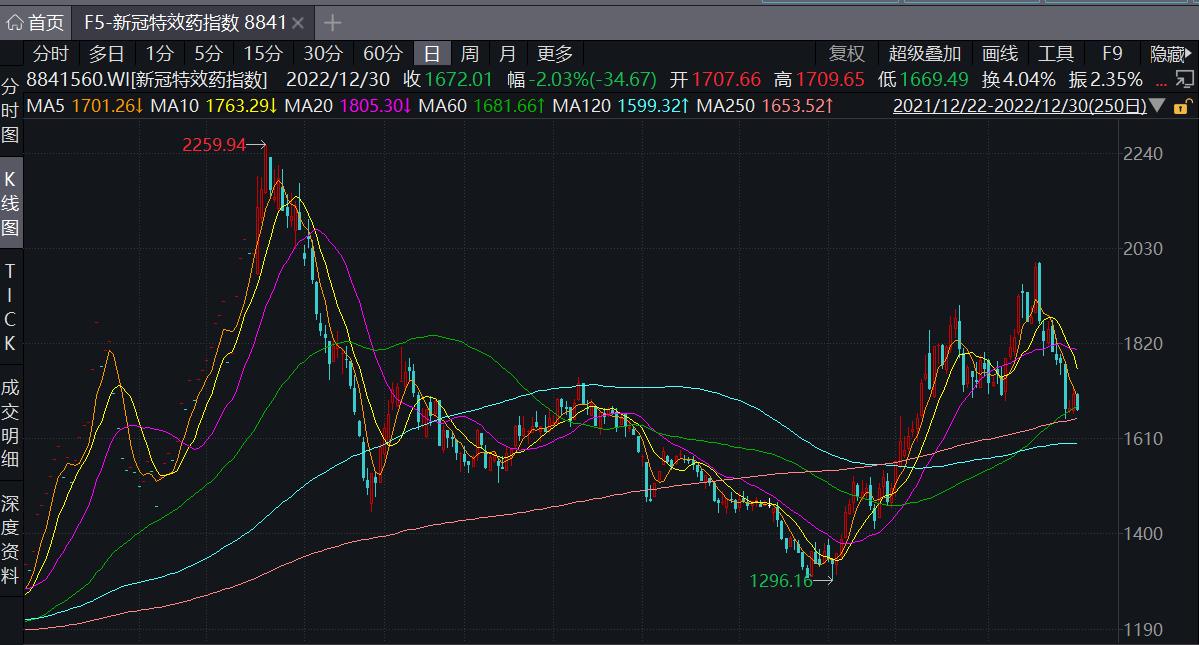
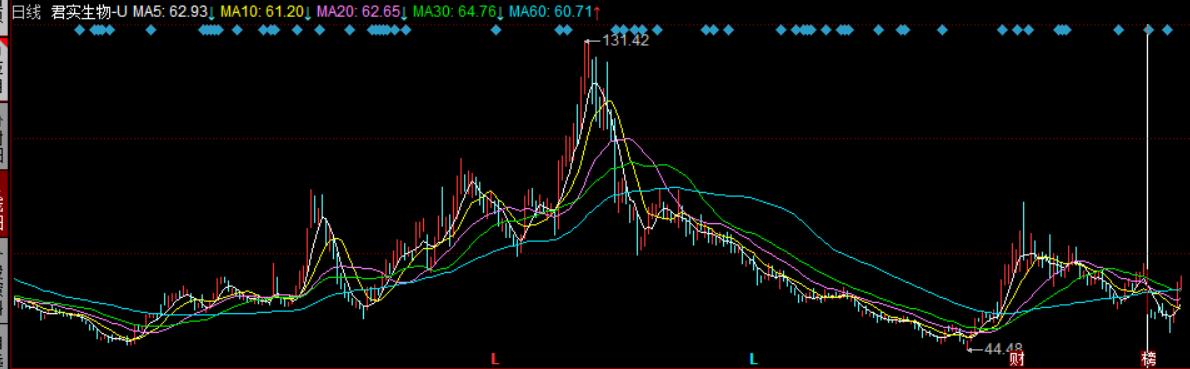
Wind数据显示,新冠特效药指数于2022年3月一度达到2259.94的高点,但自此一路走低。直至去年10月份触底反弹,近期亦有所回落。以君实生物-U为例,该股进入2022年时的股价为65元/股,5月12日创下131.42元/股的新高,成功实现翻倍。但此后股价一路走低,10月12日触及44.48元/股的低点,距离高点跌幅超过66%。
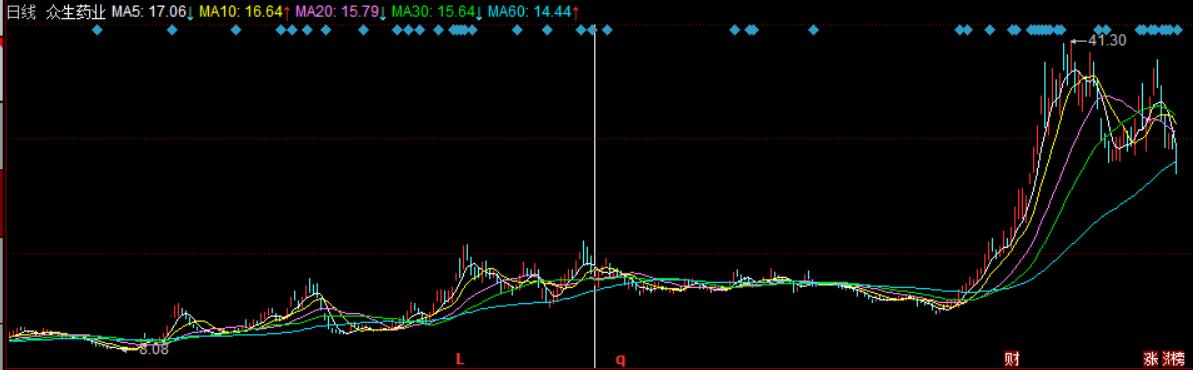
此外,新冠特效药板块也不乏众生药业这样的“妖股”诞生。进入2022年,众生药业的股价一直在10元左右徘徊,直到进入十月份,该股股价呈现爆发式上涨,并于11月22日触及41.30元/股的历史新高,年内累计涨幅超过233%。
界面新闻注意到,除了已在国内上市的辉瑞Paxlovid,以及首款国产新冠口服药阿兹夫定,国家药监局于2022年12月30日附条件批准默沙东公司新冠病毒治疗药物莫诺拉韦胶囊(商品名称:利卓瑞/LAGEVRIO)进口注册。
1月2日晚间,国药控股(01099.HK)披露称,公司控股股东中国医药集团有限公司已于2022年9月与默沙东签署合作框架协议,并获授莫诺拉韦在中国大陆境内的经销权和独家进口权。公司附属公司国药控股分销中心有限公司于2022年11月与默沙东签署经销协议,在协议期内负责莫诺拉韦在中国大陆的进口和经销。
据悉,作为全球首款获批的口服抗新冠病毒药物,莫诺拉韦目前已在40多个国家或地区获得上市许可或紧急用户许可证。国药控股表示,此次莫诺拉韦在华获批,公司将与默沙东紧密协作,加速推进药物的上市与供应。




评论