界面新闻记者 |
界面新闻编辑 | 谢欣
7月12日,第一三共和阿斯利康共同宣布,靶向HER2的抗体偶联药物 (ADC)优赫得(ENHERTU,注射用德曲妥珠单抗,Trastuzumab deruxtecan)获国家药品监督管理局(NMPA)批准,单药适用于治疗既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的,不可切除或转移性HER2低表达(IHC 1+或 IHC 2+/ISH-)成人乳腺癌患者。
这是继2023年2月得首次在华获批单药治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者后,新一代ADC药物德曲妥珠单抗在中国获批的又一适应症。
目前,国内共有三款HER2靶点的ADC药物。恩美曲妥珠单抗由罗氏研发,用于治疗早期HER2阳性乳腺癌和晚期HER2阳性乳腺癌;维迪西妥单抗由荣昌生物研发,用于治疗晚期HER2阳性胃癌和晚期HER2阳性膀胱癌;而德曲妥珠单抗由第一三共和阿斯利康共同研发,用于治疗晚期HER2阳性乳腺癌。
其中,德曲妥珠单抗被认为是目前ADC领域最强的一款产品,自上市以来,给全球各大ADC开发药企都带来了较大压力。可以说,德曲妥珠单抗是目前ADC药物最闪耀的明星。在后德曲妥珠单抗时代,留给后来者的市场空间还有多少?
国内外ADC药物靶点扎堆于HER2

在各大类型的抗体药物中,ADC是一直较先进的疗法,被称为“魔法子弹”,其将抗体的靶向选择性与高细胞毒性药物的细胞杀伤力相结合,使细胞毒性药物能够选择性地输送至肿瘤部位。
随着ADC设计和偶联技术的不断进步,迄今已有12种ADC在全球批准上市。ADC已从用于特定血液癌症的后线治疗发展为具有前景的前线治疗模式,适用于更广泛的实体肿瘤和其他适应症。

据弗若斯特沙利文数据,ADC的全球市场规模从2017年的16亿美元增长至2022年的79亿美元,年复合增长率为37.3%。预计从2022年到2030年,它仍将以30%的年复合增长率持续快速增长。
中国ADC的市场直至2020年才出现。据科伦博泰招股书中弗若斯特沙利文数据,在中国,ADC的市场规模预计由2022年8亿元增长至2030年662亿元,复合年增长率为72.8%。
全球ADC药物在研管线靶点虽呈现出多样化发展的趋势,但据医药魔方的数据,目前主要还是集中在HER2(38.4%)、EGFR(11.9%)、TROP-2(9.9%)、Claudin 18.2(9.9%)少数几个热门靶点。
国内ADC在研药物靶点也是集中在HER2(38.4%)、EGFR(11.9%)、TROP-2(9.9%)、Claudin 18.2(9.9%)、c-Met(5.96%)、PSMA(5.3%)、CD19(5.3%)这些热门靶点。
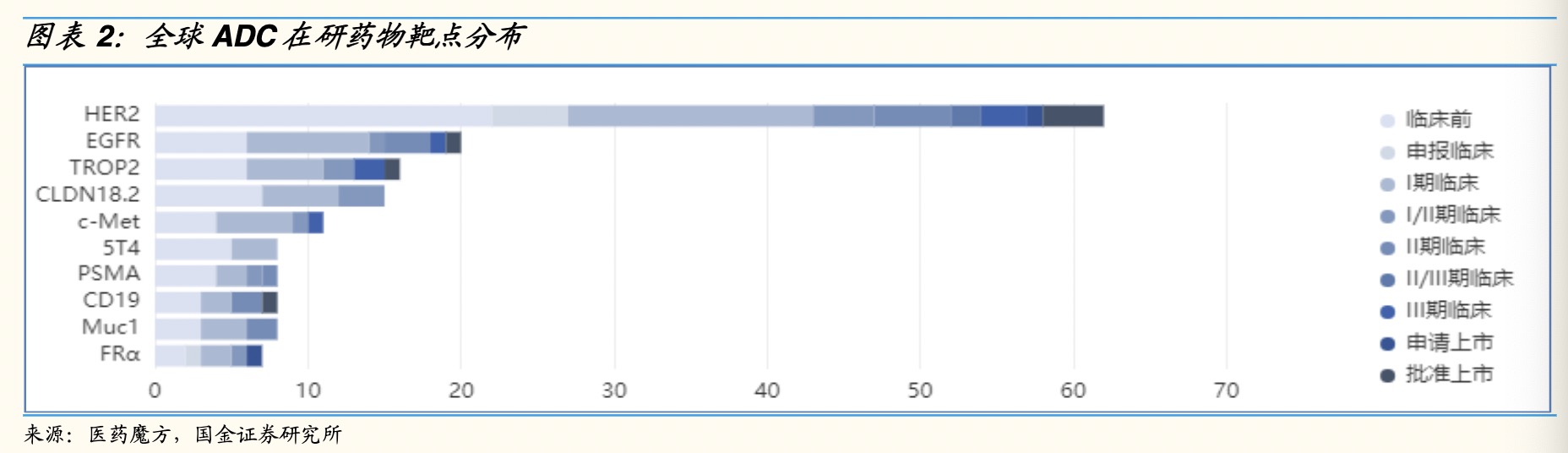
其中,HER2是一个具有经典而重要意义的靶点,因为其异常与多种疾病相关联。目前已经获得批准上市的靶向HER2的药物至少有15种,包括小分子抑制剂、单克隆抗体和联合抗体药物。这些药物的开发为针对HER2的治疗提供了多种选择。
目前国内已上市的三款ADC药物:恩美曲妥珠单抗、维迪西妥单抗、德曲妥珠单抗也均是基于此靶点。
HER2是一种细胞表面受体,其在各种正常组织中的表达较低,但在肿瘤细胞中可出现过度表达并异常激活,从而促进异常生长和存活,进而导致乳腺癌(BC)和胃肠道(GI)癌症,例如胃癌(GC)、结直肠癌(CRC)和食道癌等不同类型的癌症的发展。
从布局的适应症来看,ADC药物的集中度也非常高。据医药魔方、东亚前海证券的数据,95.17%的管线布局的适应症均是肿瘤,其次是自身免疫性疾病(1.75%)、细菌感染(0.66%)、湿性年龄相关性黄斑变性(0.66%)等。
而在布局的主要肿瘤类型中,又以乳腺癌、非小细胞肺癌、卵巢癌、胃癌、结直肠癌等实体瘤为主。其中,也是以HER2靶点为主。
此外,截至目前,绝大多数ADC药物处于研发早。据医药魔方、东亚前海证券研究的数据,临床前占比46.78%,临床I期占比29.93%,临床I/II期占比7%,临床II期占比7.54%。
可以说,在未来一段时间内,HER2靶点仍将占据国内ADC药物市场的半壁江山。
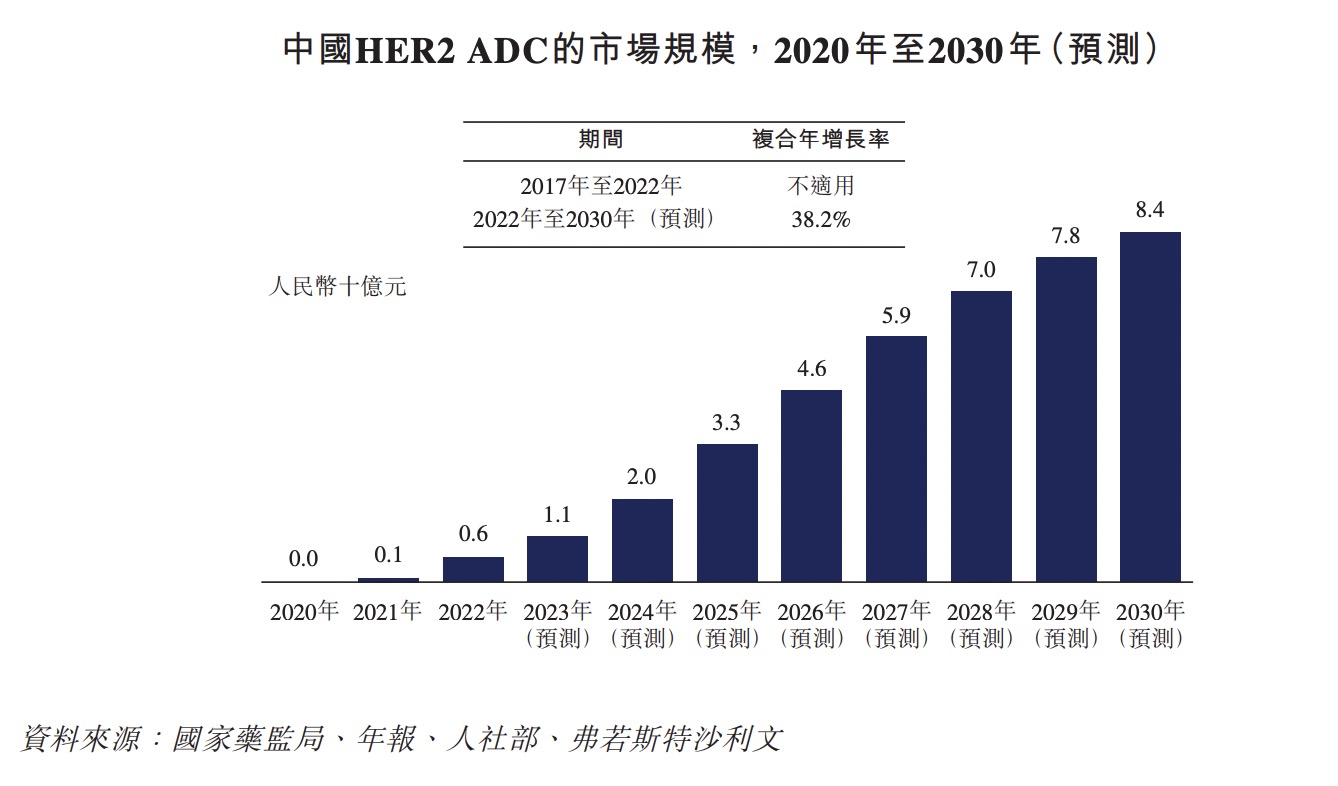
据弗若斯特沙利文数据,截至2022年,中国HER2 ADC市场规模为6亿元人民币,预计到2030年将增至84亿元人民币,自2022年以来的年复合增长率为38.2%。
具体来看,据弗若斯特沙利文数据,截至2022年,恩美曲妥珠单抗和维迪西妥单抗在中国市场上已上市的HER2 ADC药物中的市场份额分别为34.4%和65.6%。在当时,如今ADC领域最有明星相的德曲妥珠单抗尚未获得国内上市批准。
国产玩家压力山大
HER2靶点最主要被应用于乳腺癌(BC)治疗。乳腺癌是全球最高发的癌症类型,其中HER2阳性乳腺癌(HR+╱HER2–BC)是最普遍的亚型。
HER2阳性乳腺癌是最高發的乳腺癌亚型,约占全球乳腺癌病例总数的55%。约5-10%的HER2阳性乳腺癌患者被诊断为晚期疾病,五年生存率为30%。
在全球范围内,HR+/HER2-乳腺癌的发病数目在2017年达到了110万例,并在2022年增至130万例,预计到2030年将达到150万例。与此同时,中国HR+/HER2-乳腺癌的发病数目在2017年为17.34万例,增至2022年的18.76万例,预计到2030年将达到20.38万例。
罗氏的恩美曲妥珠单抗是全球第一个获批用于实体瘤(乳腺癌)的ADC,已获FDA批准上市的适应症包括“HER2阳性早期乳腺癌的辅助治疗”,以及“HER2阳性转移性乳腺癌的二线治疗”。恩美曲妥珠单抗也于2020年1月成为中国大陆第一个获批上市的ADC药物。
截至目前,罗氏的恩美曲妥珠单抗在中国已经获批HER2阳性早期乳腺癌的辅助治疗,HER2 阳性的转移性乳腺癌的二线治疗。
在针对HER2阳性早期乳腺癌的辅助治疗的临床试验中,恩美曲妥珠单抗组的3年无浸润性肿瘤复发生存率(iDFS)显著高于单独使用曲妥珠单抗治疗的对照组(88.3% vs 77%,HR 0.5, 95% CI 0.39~0.64;P<0.001),将HER2阳性早期乳腺癌患者复风险降低了50%。
在针对HER2阳性局部晚期或转移性乳腺癌二线治疗的临床试验中,恩美曲妥珠单抗单药与化疗组合“拉帕替尼+卡培他滨”的头对头III期临床试验(EMILIA)结果显示:两者的中位总生存期(mOS)30.9个月VS 25.1个月;中位无进展生存期(mPFS)9.6个月VS 6.4个月;客观缓解率(ORR)43.6% VS 30.8%;中位持续缓解时间(mDOR)12.6个月VS 6.5个月,可以说恩美曲妥珠单抗完胜化疗组合疗法。
不过,德曲妥珠单抗的横空出世可以说完全瓦解了恩美曲妥珠单抗作为乳腺癌二线治疗标准疗法的地位。在与恩美曲妥珠单抗的头对头试验中,德曲妥珠单抗的疗效取得绝对优势。
在针对HER2阳性转移性乳腺癌2线疗法(DESTINY-Breast03试验)试验中,随机、开放标签、德曲妥珠单抗和恩美曲妥珠单抗的头对头III期临床试验DESTINY-Breast03研究旨在评估二者在既往接受过曲妥珠单抗和紫杉烷治疗的HER2阳性转移性乳腺癌患者中的疗效和安全性。研究结果显示,在524例随机分组的患者中,德曲妥珠单抗组和恩美曲妥珠单抗组12个月无进展生存率分别为75.8%和34.1%。12个月时,德曲妥珠单抗组和恩美曲妥珠单抗组总生存率分别为94.1%和85.9%。德曲妥珠单抗组确认的客观缓解率(ORR)为79.7%,而恩美曲妥珠单抗为34.2%。
德曲妥珠单抗确认的客观缓解率(ORR)为79.7%,恩美曲妥珠单抗为34.2%。对德曲妥珠单抗有反应的患者中,16.1%达到完全缓解(CR),63.6%达到局部缓解(PR),16.9%疾病稳定(SD),1.1%出现疾病进展(PD)。
此外,德曲妥珠单抗在试验对象前均接受过恩美曲妥珠单抗治疗,中位治疗线数为6的情况下,仍取得了亮眼的临床数据。
在针对HER2阳性乳腺癌后线治疗的临床试验中,开放标签、单臂、多中心的II期临床研究DESTINY-Breast01研究显示:184例HER2阳性乳腺癌患者已经使用了两种或两种以上治疗方案(中位治疗线数为6),接受德曲妥珠单抗5.4mg/kg的治疗后,中位随访11.1个月,客观缓解率(ORR)达60.9%(n=111);其中4.3%(n=8)的患者达到完全缓解率(CR);56%(n=103)的患者达到局部缓解(PR),中位持续缓解时间(mDOR)为14.8个月,中位无进展生存期(mPFS)为16.4个月。
如今德曲妥珠单抗又拿下国内首个有助于HER2低表达转移性乳腺癌患者延缓疾病进展和延长生存期的创新靶向疗法的适应症。HER2低表达的乳腺癌患者占全部类型的45% - 55%。可以说,德曲妥珠单抗是目前在国内乃至全球范围内HER2靶点的ADC药物在乳腺癌领域的绝对霸主。
在针对HER2低表达转移性乳腺癌临床试验中,无论HER2表达水平如何(IHC 1+ 和 IHC 2+/ISH-),德曲妥珠单抗在HR阳性或HR阴性、HER2低表达转移性乳腺癌患者的总体试验人群中均展示出一致的疗效。在针对所有患者基于BICR的PFS分析中,德曲妥珠单抗相比化疗将患者的疾病进展或死亡风险降低了50%(PFS HR 0.50;95% CI:0.40-0.63;p<0.001)。研究结果还显示,德曲妥珠单抗相比化疗将患者的死亡风险降低了36%(OS HR 0.64;95% CI:0.49-0.84;p=0.001),中位总生存期增加了6个月以上。
在中国还有八种针对乳腺癌的HER2 ADC候选药物处于2期或更高阶段。其中,包括科伦博泰的A166和荣昌生物的维迪西妥单抗。后来者们如果单纯从治疗效果上挑战德曲妥珠单抗在乳腺癌领域的霸主地位难度很大。
例如,科伦博泰的HER2靶点ADC药物A166正处于NDA注册期间,适应症为晚期HER2+乳腺癌。
截止于2022年7月13日,对于参与4.8和6.0 mg/kg 科伦博泰A166队列的58名患者进行了疗效评估。所有患者之前都接受过HER2靶向治疗,中位数为四线治疗,其中包括:曲妥珠单抗接受率为100%(58/58),抗HER2 TKI接受率为94.8%(55/58),帕妥珠单抗接受率为32.8%(19/58),HER2 ADC治疗接受率为20.7%(12/58)。在接受A166治疗的整体58名患者中,A166达到了70.7%的整体ORR(整体有效率,41/58),4.8 mg/kg剂量组的ORR为73.9%(17/23),而6.0 mg/kg剂量组的ORR为68.6%(24/35)。4.8 mg/kg剂量组的中位PFS(无进展生存期)为12.3个月,而6.0 mg/kg剂量组的中位PFS为9.4个月。4.8 mg/kg剂量组的中位DOR(持续有效期)为11.0个月,而6.0 mg/kg剂量组的中位DOR为8.3个月。
荣昌生物的维迪西妥单抗针对HER2阳性乳腺癌和针对HER2低表达乳腺癌则均处于临床3期。
在针对HER2阳性乳腺癌临床试验中,接受维迪西妥单抗1.5mg/kg、2.0mg/kg 及2.5mg/kg 剂量的患者亚组,总客观缓解率(cORR)分别为22.2%、42.9%及40.0%,中位无进展生存期(mPFS)分别为4.0个月、5.7个月及6.3个月。
在针对HER2低表达乳腺癌临床试验中,维迪西妥单抗的总客观缓解率(cORR)和中位无进展生存期(mPFS)分别为39.6%和5.7个月,其中35名IHC2+/FISH-患者的客观缓解率(ORR)和中位无进展生存期(mPFS)分别为42.9%和6.6个月,13名IHC 1+患者的ORR和mPFS分别为30.8%和5.5个月。
国内还有像恒瑞医药、Fosun Pharmaceutical、浙江医药、石药集团、美雅珂、DAC Biotech Company这六位挑战者。其中,恒瑞医药SHR-A181的转移性乳腺癌和HER2低表达复发或转移性乳腺癌也均处于临床3期。
德曲妥珠单抗除了在不断探索与抗PD-1抗体等免疫疗法的联合应用外,还不断扩大适应症范围。
强大的临床疗效以及适应症的不断扩展让德曲妥珠单抗一度备受关注。据Nature Reviews Drug Discovery预测,到2026年,德曲妥珠单抗在全球的销售额将达到62亿美元,占据全球最早上市的10款ADC药物近40%的份额。
德曲妥珠单抗已在胃癌、非小细胞肺癌、结直肠癌等其他实体瘤的临床研发中取得了不错的进展。这给国内已在研发进度上落后一步的很多ADC开发药企带来了巨大的压迫感。
在国际上,已有后来者主动放弃。去年12月,考虑到德曲妥珠单过于强大,Ambrx公司主动宣布暂停了与恩美曲妥珠单抗类似的ARX788的研发工作。




评论