界面新闻记者 |
界面新闻编辑 | 谢欣
7月27日,国家药监局官(NMPA)网显示,仁会生物的贝那鲁肽获批新适应证。据丁香园insight数据库,本次获批的适应证为肥胖。也就是说,这是继本月初,华东医药的利拉鲁肽注射液获批用于肥胖或超重适应证后,又一款获批的“减肥针”产品。
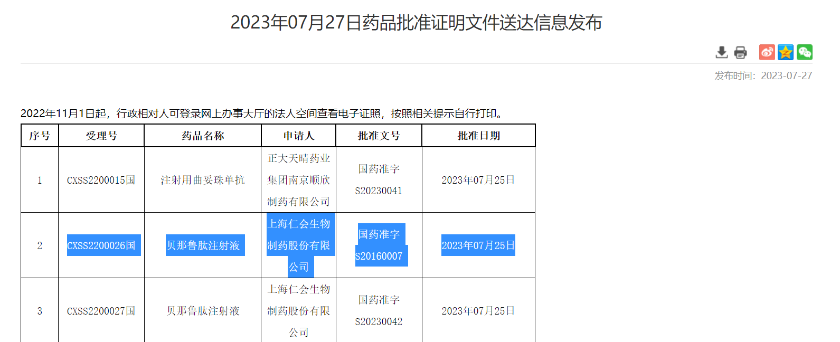
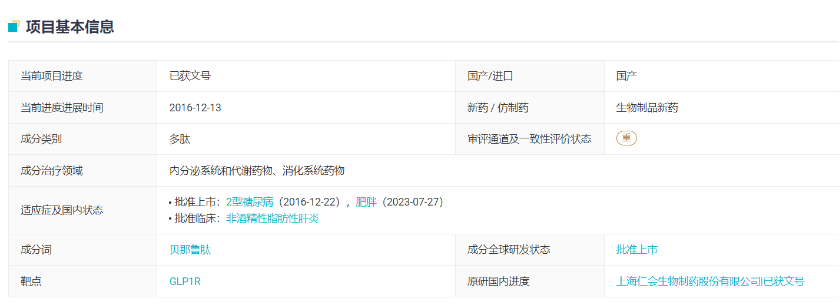
另外,利拉鲁肽的原研方为丹麦药企诺和诺德,华东医药产品为生物类似药。而贝那鲁肽为1类新药,即仁会生物的原研产品。换而言之,贝那鲁肽是国内获批的首个国产原研减肥新药。
贝那鲁肽和利拉鲁肽都属于GLP-1(胰高血糖素样肽-1)受体激动剂产品。该类产品主要用于治疗2型糖尿病,又因较低的不良反应和较高的减重效果被开发用于肥胖的治疗。其中明星产品还有诺和诺德的司美格鲁肽等。
不过值得注意的是,以药代动力学特性来分,GLP-1受体激动剂可分为短效和长效两类。前者半衰期最短也有2-4小时,如艾塞那肽需要每日给药两次;后者半衰期较长,如利拉鲁肽为12-14小时,因此每日给药一次,司美格鲁肽则为周制剂。
而贝那鲁肽的半衰期仅为11分钟,每日需要给药三次。这无疑将影响患者的选择和用药依从性。换而言之,在本就十分拥挤的降糖、减重领域,“一天扎三针”的贝那鲁肽注射液虽然跑在前面,但竞争力也相当有限。

据2020年8月的仁会生物招股书(注册稿),贝那鲁肽注射液在超重/肥胖治疗领域新增的适应证研发代号为BEM-014(曾为HYBR-014)。BEM-014的主要成分即为贝那鲁肽。
据招股书和官网信息,仁会生物于2019年5月正式启动BEM-014减重适应证Ⅲ期临床研究。该研究是一项BEM-014辅助生活方式干预,治疗成人超重/肥胖疗效和安全性的随机、双盲、安慰剂平行对照、多中心临床试验。
该试验的主要终点一是16周时,治疗组受试者相对于基线期体重平均下降的百分比与安慰剂组的差值;二是16周时,治疗组与安慰剂组体重相对于基线至少降低5%的受试者比例的比较。
中国临床试验注册中心官网显示,该研究由中国人民解放军总医院母义明教授担任研究组长,全国35家研究中心参与。研究共纳入423例超重/肥胖成人受试者,其中试验组样本量为282例,对照组样本量为141例。整个研究持续到2020年12月。
2019年9月,该试验首位受试者入组并完成给药,2020年11月完成全部受试者入组,2021年6月完成末例受试者出组。此后仁会生物表示正积极开展该药物的上市注册工作,拟用商品名“菲塑美”已取得国家注册商标证书,已完成产品市场调研工作,正在组建项目团队,开展前期市场推广。2022年3月,贝那鲁肽注射液减重适应证上市申请获NMPA受理。不过,记者通过公开途径未搜索到关于前述Ⅲ期研究的结果和数据。
而中国临床试验注册中心官网还显示,这项临床试验中,贝那鲁肽的使用方式为一天三次。毫无疑问,这种频繁的给药方式,将大大降低这款产品的竞争力。
此外,贝那鲁肽自获批上市以来就一直伴有争议。除了用药依从性问题。贝那鲁肽在有效性上也存在疑问。
2016年12月,贝那鲁肽获NMPA批准,其首个适应证为治疗2型糖尿病。2017年1月,NMPA药品审评中心出具的《贝那鲁肽注射液(CxSS1500006)中请上市技术审评报告》称,支持该药上市申请的Ⅲ期研究结果显示,作为主要评价指标的HbA1c,治疗12周后0.2mg组HbA1c较安慰剂组有显著降低。以全分析集为例,安慰剂和0.2mg剂量组受试者的HbA1c相对基线分别降低0.13±0.081(-0.0,0.3)和0.38±0.044[±SE](95%Cl:0.3,0.5),差值为0.25%,达到优效性结果,期临床结果表明其确有降糖效果,但与安慰,剂之间的差值仅为0.25%,与国际上其他几个同类产品的降糖效果相比,略显不足。
换而言之,在有效性上,贝那鲁肽并不是一款惊艳的产品。不过,仁会生物的官网上则有一份“贝那鲁肽真实世界研究数据”的研究论文,以及一份题为“贝那鲁肽真实世界研究数据振奋人心”的官方解读文章。而该论文也多次出现在仁会生物招股书中,用以证明贝那鲁肽药效。
其显示,贝那鲁肽的HbA1c降低幅度为1.37%-2.87%,不仅远高于评审报告中Ⅲ期研究的数据(0.25%),也远高于短效GLP-1受体激动剂(0.8%-1.8%)、α-糖苷酶抑制剂(0.50%)、短效磺酰脲类药物(1.00%)、格列奈类促泌剂(0.5%-1.0%)和DPP-4抑制剂(0.4%-0.9%)等其他餐后高血糖治疗药物的HbA1c降低幅度。
不过,长期从事新药临床开发工作的人士Klaith曾向界面新闻表示,该论文研究为是回顾性观察研究,数据质量可能严重偏倚,在循证医学体系中证据级别较低。而所谓“多中心”,其实也只有两家地方医院的数据。
实际上,该论文的研究者即在论文中指出,本研究中较高的基线HbA1c水平(9.02%)可能是贝那鲁肽治疗疗效提高的一个重要原因。此外,作为一项观察性和回顾性研究,缺乏随机分组和对照组是本研究的主要局限性。
此外,上市后,贝那鲁肽的销售情况也并不理想。虽然已被纳入国家医保,但2017年到2019年,贝那鲁肽的销售金额分别仅为1360.71万元、2681.69万元和5588.08万元。
核心产品备受争议的同时,仁会生物自己也颇为不顺。2020年7月31日,仁会生物在上交所科创板成功过会。但其在提交注册阶段卡壳一年多也未有结果。直到2021年10月12日,仁会生物终止注册。对此,公司官网公告披露,综合考虑自身业务情况及未来发展战略规划,公司决定调整上市计划,拟主动撤回首次公开发行股票并在科创板上市的申请,后续将择机启动上市计划。
不过,在此前的注册阶段,仁会生物共收到证监会三轮问询函,其中暴露出公司经营的诸多疑点,包括部分会计凭证入账的原始单据不齐备,销售费用支付单据提供比例较低、且部分支付单据存在异常,向学术推广会中讲课人员支付的劳务费为销售人员现金支付、且销售人员报销费用与流水记录不匹配,部分销售人员疑似存在购买发票等问题。此外,仁会生物还出现疑似商业贿赂的异常流水。直到仁会生物终止科创板上市前,公司均未做出回复。




评论