界面新闻记者 |
界面新闻编辑 | 谢欣
8月27日,康弘药业发布2023年中报。报告期内,公司营收19.20亿元,归母净利润5.25亿元,扣非净利润5.10亿元,分别同比变动8.90%、-2.19%、1.94%。换而言之,公司业绩增收不增利。
8月28日,康弘药业股价高开后迅速回落,收盘价14.77元/股,上涨1.30%,相较今年年内高点跌去超三成。
康弘药业于2015年在深交所上市,主营业务为生物制品、中成药、化学药等药品和眼科医疗器械的研发、生产与销售,涉及高血压、糖尿病等慢病防治,以及呼吸科、消化科、眼科、脑科、肿瘤等多个疾病领域。
分产品来看,化药、生物制品和中成药是康弘药业营收的主要来源,医疗器械在营收中的占比不足0.5%。今年上半年,前三者营收分别为3.64亿元、8.75亿元、6.76亿元,分别同比变动-21.51%、28.22%、10.75%。
也就是说,化药是康弘药业唯一下滑的主要板块。这一趋势始于2020年,彼时,化药板块营收为12.81亿元,该板块的营收占比也由当时的约40%降至今年上半年的近20%。

其原因是近几年持续的国家集采。自2020年起,康弘药业4种在销主要化学仿制药右佐匹克隆片、枸橼酸莫沙必利片、盐酸文拉法辛缓释片、阿立哌唑口崩片先后中标。
其中,盐酸文拉法辛缓释片为主流抗抑郁药,公司该产品2020年的销售收入为4.56亿元,分别占公司化药营收和总营收的35.60%和13.84%。第五批集采中,康弘药业降价约六成。据米内网数据,2022年,中国公立医疗机构终端的盐酸文拉法辛缓释片销售额大跌32%,市场跌破10亿元。
治疗精神分裂症的阿立哌唑口崩片则于2022年11月进入第七批集采。今年2月,康弘药业表示,公司中标产品单价下调79%左右,短期内仍会受一定影响。此外,其他三个中标产品所受降价影响已趋于稳定。
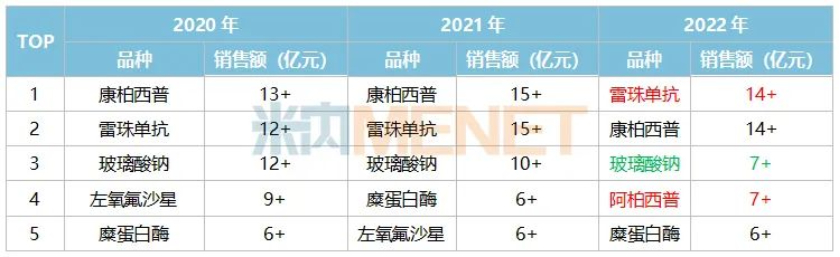
除化药板块外,康弘药业的生物制药板块也颇为紧张。该板块唯一的上市产品即为康柏西普眼用注射液。这是一款靶向VEGF(血管内皮生长因子)的重组融合蛋白,2013年首次在国内获批,用于治疗湿性年龄相关性黄斑变性(AMD)。在此之前,诺华的同类竞品雷珠单抗在2011年获批进口。2017年,两者均纳入国家医保,随后放量拉伸业绩。此外,拜耳的同类竞品阿柏西普分别在2018年获批进口,2019年进入医保目录。
丁香园insight数据库显示,目前,雷珠单抗、康柏西普、阿柏西普分别在国内获批6项、4项、2项适应证。据米内网数据,以2022年中国公立医疗机构药品终端销售额统计,雷珠单抗以3000万左右的差距首次反超康柏西普,成为眼科用药新的TOP1品种。
此外,随着前述两个进口产品专利到期,国内生物类似药也已紧随其后,齐鲁制药的雷珠单抗、阿柏西普生物类似药均已进入上市申请阶段,另有数家国内公司产品处于临床III期。而被认为是第二代阿柏西普的Brolucizumab(布西珠单抗)也于今年8月2日在国内递交上市申请。该药由诺华研发,相比于上一代药物,Brolucizumab每三个月注射一次,减少了患者的就诊次数,利于提高依从性。
尽管竞争日渐激烈,康弘药业显然还对康柏西普寄予厚望。今年2月,公司谈及2023的业绩预计增长点时表示,康柏西普的第四个适应证视网膜静脉阻塞(RVO)已在今年年初进入国家医保目录,对公司增加市场份额会有一定积极影响。
另外,康柏西普曾因出海失败备受关注。2021年4月,公司据临床数据中期评议结果,终止了康柏西普国际III期临床试验及在美注册上市项目。为此,公司修正2020年业绩,导致净利润减少10.15亿元,创下上市以来首亏。彼时,公司股价在一个月内接近腰斩,市值蒸发超150亿元。
不过,在此之后,创新和出海依旧是康弘药业的研发方向,其中生物制药是重点领域。今年2月,康弘药业表示,其北京公司已全面完成项目建设并通过竣工验收。后续北京工厂将承担公司在研大分子生物药物的临床样品供应及商业化生产。
具体到管线上,公司1类新药KH631通过腺相关病毒(AAV)递送目标基因,用于治疗湿性年龄相关性黄斑变性,于2022年11月分别在中美获批临床。
1类生物新药 KH903用于治疗恶性实体肿瘤,目前正处于临床II期阶段。此外,化药1类新药KH617拟用于治疗晚期实体瘤患者(包括成人弥漫性胶质瘤),分别于2022年9月和7月在中美获批临床,并于今年2月获美国食药监局(FDA)针对胶质母细胞瘤的孤儿药资格认定。该药也是公司合成生物学平台首个进入临床试验申报的产品。




评论