文|IT桔子 许梦翘
疫情中,巨头的布局颇为值得咀嚼。比如今年 2 月中旬,再融资新规定一出,PE 巨头高瓴资本直接宣布拟以 23 亿拟全额认购 CDMO 公司凯莱英的发行股份,次日,权益变动报告书立刻发布,高瓴资本的持股比例达到 8%。高瓴资本在这个节骨眼再次重仓创新药铲子股,也被市场认为是其对新冠肺炎后中国创新药研发抱有极大的信心。
制药巨头的投资可以被看做是其对某个管线未来机会的认可。近日,诺华投资了一家公司,叫 Pliant Therapeutics。2020 年 3 月 3 日,Pliant Therapeutics 宣布已通过 C 轮融资筹集了 1 亿美元,本轮融资由诺华领投,Redmile Group,Farallon Capital Management,Cormorant Asset Management,Surveyor Capital 和 Logos Capital 作为新投资者加入了此次融资。这笔融资比较有趣的点在于诺华投资的目标是一款抗肺纤维化药物。
Pliant Therapeutics 由美国生命科学领域股权众筹平台 Third Rock Ventures 于 2016 年 2 月成立,公司专注于纤维化药物的开发。Pliant 的首席执行官 Bernard Coulie 拥有超过 15 年的药物开发经验,之前在强生担任了 6 年的高层职务,他也是基因工程细菌胶囊研发公司 ActoGeniX 的联合创始人与 CEO。另外出任董事会主席的 Perry Karsen 来到 Pliant 之前曾担任 Celgene Cellular Therapeutics 的首席执行官,拥有 30 年的生物制药行业经验。
病理性纤维化是导致器官功能衰竭的病理基础之一,比如我们常听说的肝硬化便是肝的纤维化严重到了一定的程度,肾的纤维化是肾衰竭的关键过程,心力衰竭和严重心律失常的发生基础也同样是心肌的纤维化重塑。还有肺纤维化、克罗恩病、一些皮肤病等等,器官的纤维化与很多疾病的病程发展离不开关系。
Pliant Therapeutics 的目标就是研发逆转器官纤维化的药物,以帮助患者提高器官功能、提升患者生活质量、延长其生存时间,他们选择了整合素抑制剂的研发方向。
整合素是在人体细胞表面广泛表达的受体蛋白,其介导了多条信号通路,可以调节细胞周期、细胞分化和迁移、免疫应答等等。在病理性纤维化疾病当中,转化生长因子β(TGF-β) 的激活起到了至关重要的推动作用,越来越多的研究证据表明多种整合素可以诱导 TGF-β的激活,所以整合素正逐渐被认为是逆转器官纤维化的一个有效靶点 [1]。
相关的研发公司也获得了投资者们的关注,除了 Pliant 之外,另外一家关注纤维化疾病的整合素抑制剂研发商 Morphic 在 2018 年 10 月获得了 8000 万美元的 B 轮融资,该公司随后又与巨头艾伯维签下了一亿美元的合作大单,目前已登陆纳斯达克。
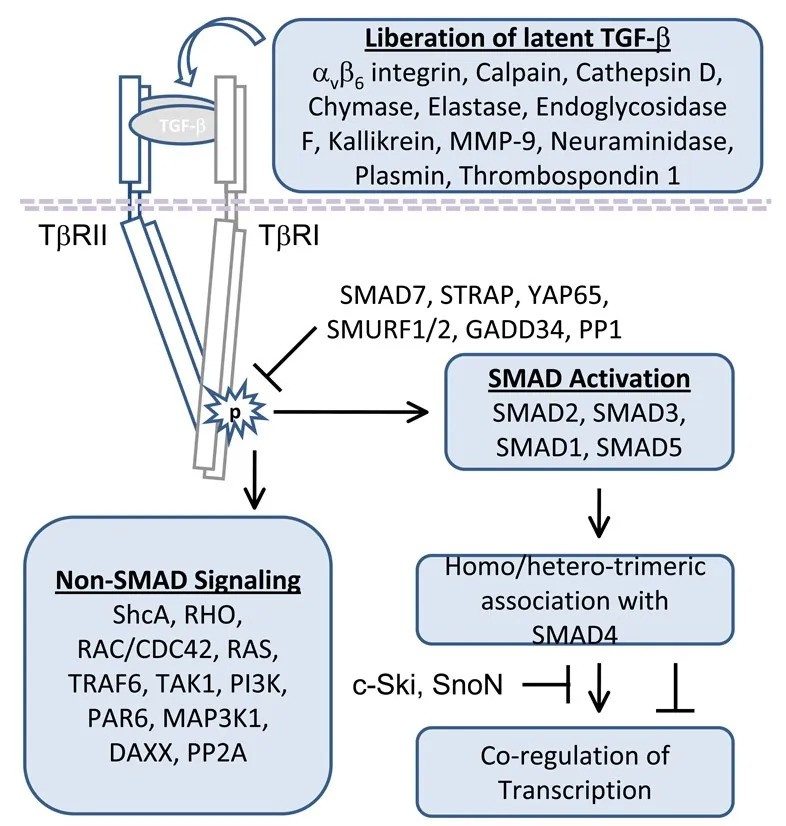
TGF-β信号通路 [2]
现阶段 Pliant 进入临床试验的共有两款药物 PLN-1474 和 PLN-74809,另外还有 3 款在研药物处于临床前与实验室阶段。诺华在本轮投资之前几个月便与 Pliant 展开过价值 8000 万美元的合作。2019 年 10 月 Pliant Therapeutics 宣布,与诺华(Novartis)达成一项战略性研发合作协议,双方将共同开发αvβ1 整合素抑制剂 PLN-1474 和其它三款整合素候选产品,这次合作可以被认为诺华在 NASH 领域的布局。NASH 全称非酒精性脂肪性肝炎,该病是脂肪肝的疾病进展,是目前美国肝移植的第二大病因,随着脂肪肝患病率不断增高,这个疾病也被认为将成为未来的肝脏头号杀手。因此治疗 NASH 的药物具有极大的市场空间,去年各大药厂都在积极参与布局 NASH 药物的研发。
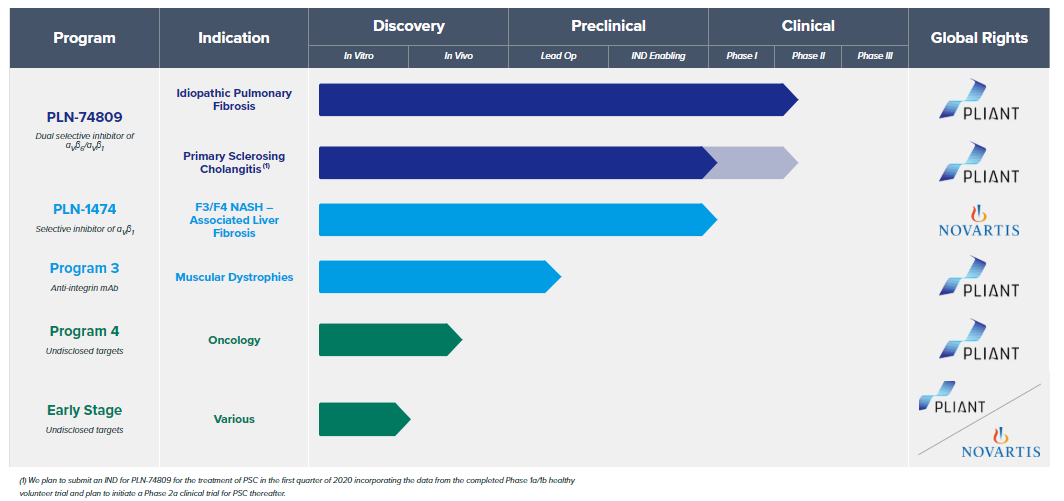
Pliant Therapeutics 研发管线 图片来源:Pliant Therapeutics 官网
而诺华 2020 年的这笔投资主要与 Pliant 的另一款药物 PLN-74809 有关。该药是靶向 αvβ1 和 αvβ6 的双重整合素抑制剂,覆盖原发性胆汁性胆管炎 (PBC) 和特发性肺纤维化(IPF)两个适应症。Pliant 的研究者发现在 Mdr2-/-小鼠模型与 PBC/PSC(原发性硬化性胆管炎) 移植患者的肝组织中,整合素 αvβ1 和 αvβ6 出现了显著的升高,并伴随肝纤维化程度加深而进一步增加。在使用 PLN-74809 之后,小鼠与患者肝切片病理显示肝组织胶原蛋白出现了显著的下降 [3]。
在以肺纤维化为适应症的 1b 期临床试验当中,PLN-74809 在从健康志愿者收集的肺泡巨噬细胞中对 TGF-β活化的抑制程度可达 70%。此外,PLN-74809 的耐受性良好,仅出现轻度不良事件,没有与药物相关的不良事件。该药已进入 IIa 期临床,并已在肺纤维化领域获得了 FDA 的孤儿药认证 [4]。
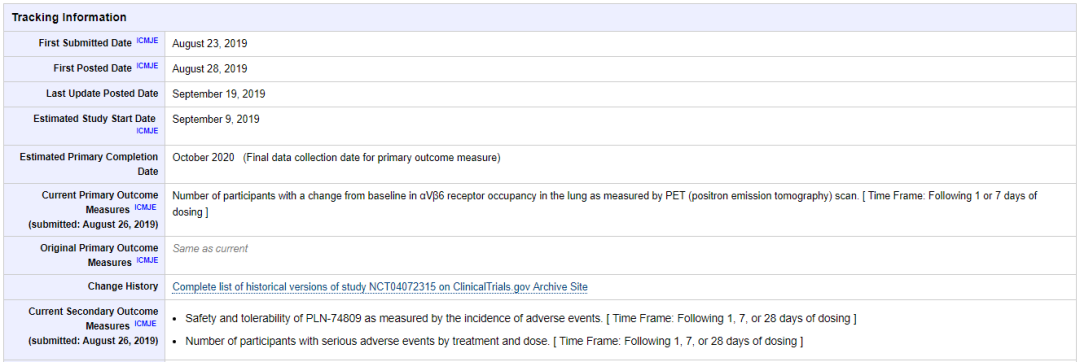
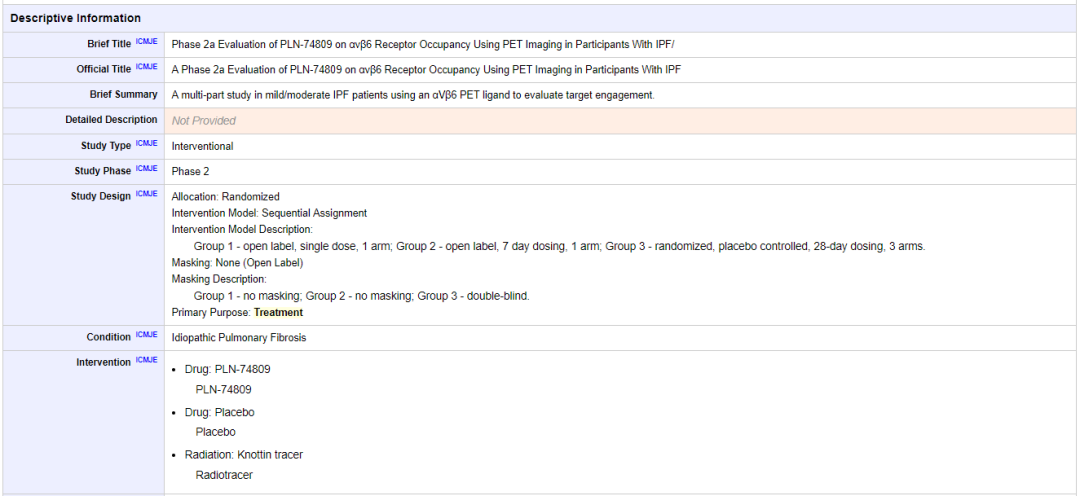
PLN-74809 IIa 期临床试验详情 来源:Clinicaltrials.gov
其实诺华在这个时间点布局 IPF 领域是一个比较耐人寻味的事情。尽管目前还不是十分的确定,但医学研究中普遍认为肺纤维化的发生和恶化与化学物质、免疫、炎症等刺激有关。IPF 的病理特点有肺损伤和纤维化、上皮细胞损伤、弥漫性肺泡损伤等 [5],一些研究者认为这种病理变化有可能证明了病毒是其中的一种病原体 [6]。病毒中,疱疹病毒在内的一些病毒与 IPF 的发生发展展现出了极大的相关性 [7]。
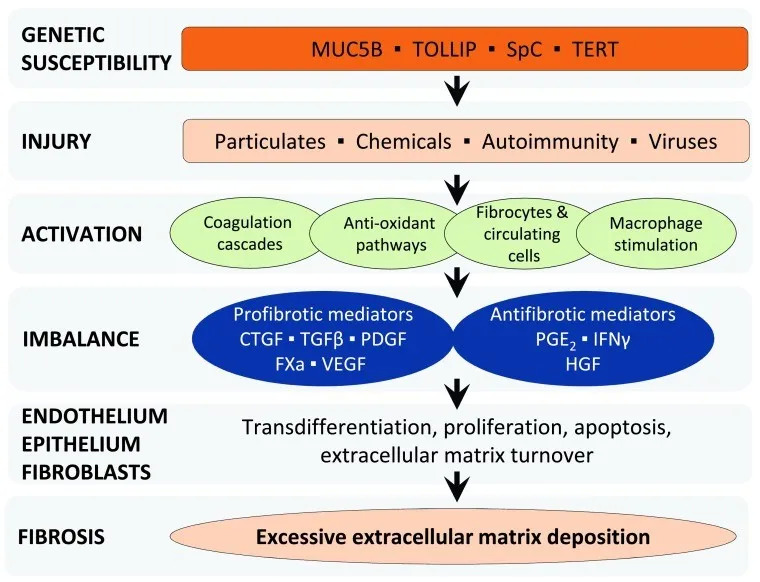
特发性肺纤维化发生机制 [8]
今年所有人最关心的就是病毒了,很多人会把新冠肺炎跟 17 年前的 SARS 相比较。一项 SARS 患者并发肺纤维化的研究中,研究者对确诊的 44 例 SARS 患者进行影像学随访观察, 包括摄胸部 X 线及 CT 扫描检查,结果发现 44 例 SARS 患者中,24 例在住院时期有不同程度的肺部纤维化改变,其中 19 例重症病例中 15 例出现肺纤维化 [9]。一项针对中国香港 97 名康复中的 SARS 患者的为期一年的随访性研究表明,与正常人群相比,有 27.8%的 SARS 幸存者表现出肺功能下降和肺纤维化增加 [10]。另外同属于冠状病毒的 MERS-CoV 也被发现了相关情况 [11]。
最近的尸检结果显示在肺纤维化程度上COVID-19 要轻于 SARS,因此它带来的影响可能较轻,人的肺具有强大的修复功能,轻症以及年轻人一段时间内有可能较好的吸收与恢复。
但是对于上了年纪的重症患者,这一点可能就要打问号了。因为随着年龄的增加,人的细胞修复能力会减弱。重症会出现广泛的肺组织损伤,尤其新冠肺炎病毒靶向 ACE2,这一靶点在 II 型肺泡上皮细胞表达丰富,病毒会攻击这些细胞。肺泡上皮损伤裸露出来的基底膜的纤维蛋白和胶原蛋白的沉积可能是未来肺纤维化发展的纤维化信号级联反应的部位 [12]。有研究表明,肺泡上皮与成纤维细胞存在相互作用,肺泡上皮的损伤能激发成纤维细胞的活化,这些活化的成纤维细胞又会引起进一步肺泡上皮损伤从而形成恶性循环 [13]。这种恶性循环在一些研究中也被认为是 IPF 的发病机制的一种 [14]。
考虑到此次病毒在全球大范围蔓延以及外国的肺炎治理问题,很多无法在轻症阶段对疾病进行介入,全球新冠肺炎重症患者数量会出现大幅的增长,未来肺纤维化患者也会出现相对应的增加。
所以,诺华在今年投资抗肺纤维化药物可能是一个值得注意的市场信号。
References:
1. Margadant C, Sonnenberg A. Integrin-TGF-beta crosstalk in fibrosis, cancer and wound healing. EMBO Rep. 2010;11(2):97–105.
2. Bierie B, Moses HL. Transforming growth factor beta (TGF-beta) and inflammation in cancer. Cytokine Growth Factor Rev. 2010;21(1):49–59.
3. https://plan.core-apps.com/tristar_aasld19/abstract/c6412aeabf1621426ae4fd981f59bd66
4. https://pliantrx.com/pliant-therapeutics-reports-positive-results-of-phase-1b-clinical-study-supporting-advancement-of-pln-74809-for-treatment-of-idiopathic-pulmonary-fibrosis/
5. Khalil N, O'Connor R. Idiopathic pulmonary fibrosis: current understanding of the pathogenesis and the status of treatment. CMAJ. 2004;171:153–160.
6. Vannella KM, Moore BB. Viruses as co-factors for the initiation or exacerbation of lung fibrosis. Fibrogenesis Tissue Repair. 2008;1:2.
7. Naik PK, Moore BB. Viral infection and aging as cofactors for the development of pulmonary fibrosis. Expert Rev Respir Med. 2010;4(6):759–771.
8. Daccord C, Maher TM. Recent advances in understanding idiopathic pulmonary fibrosis. F1000Res. 2016;5:F1000 Faculty Rev-1046. Published 2016 May 31.
9. 陆普选, 杨桂林, 余卫业, et al. Imaging follow-up of SARS patients complicated with pulmonary fibrosis SARS 患者合并肺纤维化的影像学随访 [J]. 中国医学影像技术, 2004, 020(012):1901-1903.
10. Hui DS, Joynt GM, Wong KT, Gomersall CD, Li TS, Antonio G, Ko FW, Chan MC, Chan DP, Tong MW, Rainer TH, Ahuja AT, Cockram CS, Sung JJY. Impact of severe acute respiratory syndrome (SARS) on pulmonary function, functional capacity and quality of life in a cohort of survivors. Thorax. 2005;60:401–409.
11. Das KM, Lee EY, Singh R, et al. Follow-up chest radiographic findings in patients with MERS-CoV after recovery. Indian J Radiol Imaging. 2017;27(3):342–349.
12. Ware LB, Matthay MA. The acute respiratory distress syndrome. N Engl J Med342: 1334–1349, 2000.
13. Sakai N, Tager AM. Fibrosis of two: Epithelial cell-fibroblast interactions in pulmonary fibrosis. Biochim Biophys Acta. 2013;1832(7):911–921.
14. Wynn TA. Common and unique mechanisms regulate fibrosis in various fibroproliferative diseases. J Clin Invest. 2007;117(3):524–529.



评论